题目内容
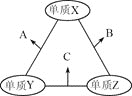
【题目】下列物质有如下转化关系![]() 有的生成物未列出
有的生成物未列出![]() ,其中:D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
,其中:D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
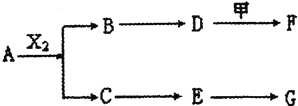
A、B、C、D、E均由Q、R、X、T四种短周期元素中的两种或三种组成,且Q、R、X、T原子序数依次增大;X的最外层电子数是电子层数的3倍;R和X相邻;Q和T同主族,Q为非金属元素,T为金属元素.则:
(1)X在周期表中的位置是 ______ ,R、X、T的原子半径从小到大的顺序为 ______ ![]() 用元素符号表示
用元素符号表示![]() ;
;
(2)A和G等物质的量反应产物的水溶液显 ______ 性,其原因用离子方程式表示为 ______ ;
(3)A和X2反应的化学方程式为 ______ ;
(4)pH均为12的D溶液和F溶液中,水电离出的c(OH-)之比为 ______ ;
(5)为保护环境,通过安装汽车尾气处理装置,使尾气中的E和CO反应转化为两种空气的成分,当反应转移1 mol电子时,生成的气体在标准状况下的总体积为 ______ L。
【答案】第二周期VIA族 O<N<Na 酸 H2O+NH4+H++NH3H2O 4NH3+5O2 ![]() 4NO+6H2O 1:1010,或10-10或10-10:1 14
4NO+6H2O 1:1010,或10-10或10-10:1 14
【解析】
X的最外层电子数是电子层数的3倍,应为O元素,R和X相邻,且原子序数小于R,则应为N元素,Q和T同主族,Q为非金属元素,T为金属元素,在元素周期表中只有H和Na符合,则Q为H元素,T为Na元素,题中信息“D为碱,金属甲在G的浓溶液中会钝化”,说明金属甲能与碱反应,则甲为Al,结合“A、B、C、D,E均由Q,R、X、T四种短周期元素中的两种或三种组成”可知G应为HNO3,则E为NO2,C为NO,A能与氧气反应生成NO,且含有N元素,应为NH3,则B为H2O,D为NaOH,F应为NaAlO2。
(1)X为氧元素,在周期表中的位置是:第二周期,ⅥA族,R为N,X为O,T为Na,原子半径从小到大的顺序为:O<N<Na;
(2)NH3和G(HNO3)等物质的量反应生成的产物为硝酸铵,为强酸弱碱盐,铵根离子水溶液水解呈酸性,水解方程式为H2O+NH4+H++NH3H2O;
(3)A(NH3)和X2(O2)反应的化学方程式为:4NH3+5O2 ![]() 4NO+6H2O;
4NO+6H2O;
(4)pH均为12的NaOH溶液和NaAlO2溶液中,水电离出的c(OH-)之比为10-12:10-2=1:1010,或10-10或10-10:1;
![]() 安装汽车尾气处理装置,使尾气中的E(NO2)和一氧化碳反应转化为两种空气的成分,发生的反应为:2 NO2+4CO=N2+4CO2,反应中N元素化合价由+4价降低到0价,C元素化合价由+2价升高到+4价,当反应转移1mol电子时,生成0.125mol N2和0.5mol CO2,体积为0.625mol×22.4L/mol=14L。
安装汽车尾气处理装置,使尾气中的E(NO2)和一氧化碳反应转化为两种空气的成分,发生的反应为:2 NO2+4CO=N2+4CO2,反应中N元素化合价由+4价降低到0价,C元素化合价由+2价升高到+4价,当反应转移1mol电子时,生成0.125mol N2和0.5mol CO2,体积为0.625mol×22.4L/mol=14L。

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】CoCO3可用作选矿剂、催化剂及家装涂料的颜料。以含钴废渣(主要成份CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Co2+ | 7.6 | 9.4 |
Al3+ | 3.0 | 5.0 |
Zn2+ | 5.4 | 8.0 |
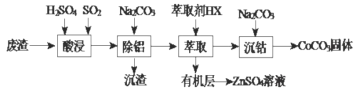
下列说法不正确的是( )
A.“酸溶”时发生氧化还原反应的离子方程式Co2O3+SO2+2H+=2Co2++H2O+SO42-
B.“除铝”过程中需要调节溶液 pH 的范围为5.0~5.4
C.在实验室里,“萃取”过程用到的玻璃仪器主要有分液漏斗、烧杯
D.在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672L(标准状况),则该钴氧化物的化学式为CoO