题目内容
12.NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如左图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如右图.下列说法正确的是( )
| A. | NH3催化还原NO为吸热反应 | |
| B. | 过程Ⅰ中NH3断裂非极性键 | |
| C. | 过程Ⅱ中NO为氧化剂,Fe2+为还原剂 | |
| D. | 脱硝的总反应为:4NH3(g)+4NO(g)+O2(g) $\stackrel{催化剂}{?}$4N2(g)+6H2O(g) |
分析 A.反应物总能量高于生成物总能量,为放热反应;
B.NH3断裂极性键;
C.NO→N2,化合价由+2→0,化合价降低,得电子作氧化剂,Fe2+在反应前后没有发生变化,故作催化剂;
D.由图象的,脱硝的总反应为:4NH3(g)+4NO(g)+O2(g) $\stackrel{催化剂}{?}$4N2(g)+6H2O(g).
解答 A.反应物总能量高于生成物总能量,为放热反应,故NH3催化还原NO为放热反应,故A错误;
B.NH3断裂极性键,故B错误;
C.NO→N2,化合价由+2→0,化合价降低,得电子作氧化剂,Fe2+在反应前后没有发生变化,故作催化剂,故C错误;
D.由图象的,脱硝的总反应为:4NH3(g)+4NO(g)+O2(g) $\stackrel{催化剂}{?}$4N2(g)+6H2O(g),故D正确;
故选D.
点评 本题考查了化学反应能量变化,图象分析判断,为高频考点,侧重考查学生的分析能力,注意NH3断裂极性键,题目难度中等.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
2.下列说法中不正确的是( )
①核外电子总数相同的微粒元素种类一定相同
②同位素的化学性质基本相同
③质子数相同、电子数也相同的两种微粒,不可能是一种分子和一种离子
④元素的相对原子质量取整数,就是其质量数
⑤金属氧化物可以是酸性氧化物
⑥非极性键只存在于单质中,极性键只存在于化合物中
⑦离子化合物只含离子键
⑧共价化合物不含离子键.
①核外电子总数相同的微粒元素种类一定相同
②同位素的化学性质基本相同
③质子数相同、电子数也相同的两种微粒,不可能是一种分子和一种离子
④元素的相对原子质量取整数,就是其质量数
⑤金属氧化物可以是酸性氧化物
⑥非极性键只存在于单质中,极性键只存在于化合物中
⑦离子化合物只含离子键
⑧共价化合物不含离子键.
| A. | ①④⑥⑦ | B. | ③④⑥⑦ | C. | ①②④⑥⑦ | D. | ①②⑥⑦ |
20.氯苯在染料、医药工业中有广泛的应用,某实验小组利用如图装置合成氯苯(支撑用的铁架台部分省略)并通过一定操作提纯氯苯.
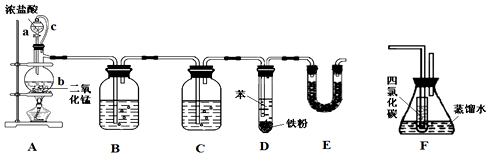
反应物和产物的相关数据列表如下:
请按要求回答下列问题.
(1)装置A中橡胶管c的作用是,装置E的作用是除去氯气和氯化氢气体,防止大气污染.
(2)实验时;使a中的浓盐酸缓缓滴下,可观察到仪器b内的现象是有黄绿色气体生成,写出反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)为证明氯气和苯发生的是取代而不是加成反应,该小组用装置F说明,则装置F置于D和E之间(填字母),F中小试管内CCl4的作用是除去氯气,还需使用的试剂是硝酸酸化的硝酸银溶液.
(4)已知D中加入5mL苯,经过提纯后收集到氯苯3.0g,则氯苯的产率为47.3%(保留三位有效数字).

反应物和产物的相关数据列表如下:
| 密度/g•cm-3 | 沸点/℃ | 水中溶解性 | |
| 苯 | 0.879 | 80.1 | 微溶 |
| 氯苯 | 1.11 | 131.7 | 不溶 |
(1)装置A中橡胶管c的作用是,装置E的作用是除去氯气和氯化氢气体,防止大气污染.
(2)实验时;使a中的浓盐酸缓缓滴下,可观察到仪器b内的现象是有黄绿色气体生成,写出反应的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)为证明氯气和苯发生的是取代而不是加成反应,该小组用装置F说明,则装置F置于D和E之间(填字母),F中小试管内CCl4的作用是除去氯气,还需使用的试剂是硝酸酸化的硝酸银溶液.
(4)已知D中加入5mL苯,经过提纯后收集到氯苯3.0g,则氯苯的产率为47.3%(保留三位有效数字).
7.在中国传统文化中“笔、墨、纸、砚”被称为“文房四宝”,下列说法中不正确的是( )
| A. | 用灼烧法可鉴别毛笔羊毫的真伪 | |
| B. | 用墨写字、画画可长久不褪色 | |
| C. | 纸及造纸原料的主要成分均是纤维素 | |
| D. | 砚石中含有一定量的SiO2,SiO2因分子间作用力大,所以硬度大,耐磨 |
17.下列不能用于鉴别SO2和CH4两种无色气体的试剂是( )
| A. | 氢氧化钠溶液 | B. | 品红溶液 | ||
| C. | 澄清石灰水 | D. | 酸性高锰酸钾溶液 |
4.下列反应表示氮的固定作用的是( )
| A. | N2与H2在一定条件下合成NH3 | B. | NH3经催化氧化生成NO | ||
| C. | NO和O2反应生成NO2 | D. | 由NH3制碳铵和尿素 |
1.NA表示阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,74g乙酸甲酯中含共用电子对数为11NA | |
| B. | 1mol Cl2通入足量的水中,转移电子数为NA | |
| C. | 足量的铁粉与200mL1 mol•L-1硝酸完全反应生成H2的分子败为0.1NA | |
| D. | 30g葡萄糖和乙酸的混合物中含碳原子数为2NA |
2. 常温下,向1L 0.1mo1•L-1NH4C1溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的浓度变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )
常温下,向1L 0.1mo1•L-1NH4C1溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的浓度变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )
 常温下,向1L 0.1mo1•L-1NH4C1溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的浓度变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )
常温下,向1L 0.1mo1•L-1NH4C1溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的浓度变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是( )| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | 随着NaOH的加入,NH4+与NH3•H2O物质的量总量减少 | |
| C. | 当n(NaOH)=0.05mol时,溶液中有:c(C1-)>c(Na+>c(NH4+>c(OH-)>c(H+) | |
| D. | 在M点时,n(OH-)+0.05═a+n(H+) |