题目内容
下列说法正确的是( )
| A、固体氯化钠不导电,所以氯化钠是非电解质 |
| B、铜丝能导电,所以铜是电解质 |
| C、氯化氢是电解质,其水溶液能导电 |
| D、CO2的水溶液能导电,所以CO2是电解质 |
考点:电解质与非电解质
专题:
分析:水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;单质,混合物不管在水溶液中或熔融状态下能够导电与否,都不是电解质或非电解质.
解答:
解:A、氯化钠固体没有自由移动的离子,所以不导电,但氯化钠的水溶液能导电,所以氯化钠是电解质,故A错误.
B、无论电解质还是非电解质都必须是化合物,铜丝是单质不是化合物,所以铜丝既不是电解质也不是非电解质,故B错误.
C、氯化氢的水溶液能导电,所以氯化氢是电解质,故C正确.
D、二氧化碳的水溶液导电,电离出自由移动离子的物质是碳酸不是二氧化碳,所以二氧化碳是非电解质,故D错误.
故选C.
B、无论电解质还是非电解质都必须是化合物,铜丝是单质不是化合物,所以铜丝既不是电解质也不是非电解质,故B错误.
C、氯化氢的水溶液能导电,所以氯化氢是电解质,故C正确.
D、二氧化碳的水溶液导电,电离出自由移动离子的物质是碳酸不是二氧化碳,所以二氧化碳是非电解质,故D错误.
故选C.
点评:本题考查了电解质和非电解质的判断,难度不大,易错题是D,注意能导电的不一定是电解质,如金属;电解质不一定导电,如氯化钠固体.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列溶液中肯定为酸性的是( )
| A、含H+的溶液 |
| B、pH<7的溶液 |
| C、c(OH-)<c(H+)的溶液 |
| D、能和NaOH发生反应的溶液 |
下列说法正确的是( )
| A、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 |
| B、用PH试纸测得氯水的PH约为3 |
| C、纯净的H2在Cl2中安静的燃烧,发出苍白色的火焰,集气瓶口有白烟生成 |
| D、氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
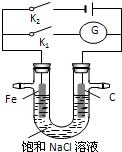

| A、K1闭合,铁棒上发生的反应为2H++2e-→H2↑ |
| B、K1闭合,石墨棒周围溶液pH逐渐升高 |
| C、K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D、K2闭合,电路中通过0.4NA个电子时,两极共产生标况下4.48L气体 |
下列事实不能用勒夏特列原理解释的是( )
①由H2、I2蒸气、HI气体组成的平衡体系加压后颜色变深
②黄绿色的氯水光照后颜色变浅
③使用催化剂可加快SO2转化为SO3的速率
④在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去.
①由H2、I2蒸气、HI气体组成的平衡体系加压后颜色变深
②黄绿色的氯水光照后颜色变浅
③使用催化剂可加快SO2转化为SO3的速率
④在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去.
| A、②③ | B、②④ | C、①③ | D、①④ |
下列离子方程式书写正确的是( )
| A、CuSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓ |
| B、澄清石灰水与稀盐酸反应:OH-+H+=H2O |
| C、NaHSO3溶液与NaHSO4溶液混合:SO32-+2H+=H2O+SO2↑ |
| D、铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu |
已知①NH3(g)+HCl(g)═NH4Cl(s)?△H 1=-176kJ?mol-1
②NH3(g
NH3(aq)?△H 2=-35.1kJ?mol-1
③HCl(g)
HCl(aq)?△H 3=-72.3kJ?mol-1
④NH3(aq)+HCl(aq)═NH4Cl(aq)?△H 4=-52.3kJ?mol-1
⑤NH4Cl(s)
NH4Cl(aq)?△H 5
则第⑤个反应方程式中的△H5为( )(单位为 kJ?mol-1)
②NH3(g
| ||
③HCl(g)
| ||
④NH3(aq)+HCl(aq)═NH4Cl(aq)?△H 4=-52.3kJ?mol-1
⑤NH4Cl(s)
| ||
则第⑤个反应方程式中的△H5为( )(单位为 kJ?mol-1)
| A、+335.7 |
| B、-335.7 |
| C、+16.3 |
| D、-16.3 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、7.8g 由Na2S和Na2O2组成的混合物中含有阴离子的数目为 0.1NA |
| B、0.1molAlCl3完全转化为胶体,生成胶体粒子的数目0.l NA个 |
| C、标准状况下,22.4 L乙醇中含有分子的数目为NA |
| D、在过氧化钠与水的反应中,每生成0.1mol 氧气,转移电子的数目为0.4 NA |