题目内容
15.下列说法正确的是( )| A. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | 0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(Na+)=c(CH3COO-) | |
| C. | 浓度均为0.10mol/L的氨水和氯化铵溶液等体积混合后:c(NH3•H2O)+c(NH4+)=0.1mol/L | |
| D. | pH=3的盐酸和pH=11的氢氧化钡等体积混合pH>7 |
分析 A.pH=11的氨水中氢氧根离子浓度与pH=3的盐酸中氢离子浓度相等,一水合氨为弱电解质,电离程度不大,二者等体积混合,氨水过量;
B.根据物料守恒判断;
C.根据物料守恒判断;
D.pH=3的盐酸和pH=11的氢氧化钡等体积混合,恰好完全反应得到氯化钡溶液.
解答 解:A.pH=11的氨水中氢氧根离子浓度与pH=3的盐酸中氢离子浓度相等,一水合氨为弱电解质,电离程度不大,二者等体积混合,氨水过量,一水合氨电离程度大于铵根离子水解程度导致溶液呈碱性,溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+),故A错误;
B.根据物料守恒:2c(Na+)=c(CH3COO-)+c(CH3COOH),故B错误;
C.混合后氮元素存在形式:NH3•H2O、NH4+,根据N元素物料守恒:c(NH3•H2O)+c(NH4+)=0.1mol/L,故C正确;
D.pH=3的盐酸中氢离子浓度为0.001mol/L,pH=11的氢氧化钡溶液中氢氧根离子为0.001mol/L,等体积混合恰好完全反应得到氯化钡溶液,溶液呈中性,故D错误.
故选:C.
点评 本题考查离子浓度大小比较、溶液酸碱性定性判断等,注意电荷守恒、微粒守恒、质子恒等式在离子浓度等量关系中应用.

练习册系列答案
相关题目
3.纳米技术是正在崛起的新科技,它研究的粒子直径在1~100nm之间.在此范围内物质的性质发生很大变化.例如Cu的直径加工成几个纳米时,会在空气中剧烈燃烧.纳米TiO2是理想的光催化剂,光照时在常温下可将汽车尾气中氮、硫的氧化物氧化成相应的酸,它还可以将废水中的有害物质快速氧成CO2和H20、作抗菌材料等.以下有关说法中正确的是( )
| A. | 纳米铜比纳米铁金属活动性更强 | |
| B. | 纳米铜在反应中可能作氧化剂 | |
| C. | 纳米TiO2在不同溶剂中均形成了胶体 | |
| D. | 纳米TiO2有很强的氯化性 |
3.某课外活动小组的同学对“菠菜与豆腐同食会引起结石”的说法产生了兴趣.于是查阅了相关资料,并进行了实验操作欲检测菠菜中草酸盐的含量.查阅资料得知:
Ⅰ.菠菜中富含可溶性草酸盐,易与豆腐中的钙盐形成不溶于水能溶于稀硫酸的草酸钙(CaC2O4)
Ⅱ.有关专家建议食用高草酸蔬菜的同时,适当摄入高钙食物,使二者在肠道内结合成草酸钙沉淀,并随着大便排出体外.以免草酸进入血液中与人体内的血钙结合,形成血液中的草酸钙需经肝脏、肾脏、尿道,随着小便排出体外,大量草酸钙流经肾脏,提升了泌尿系统结石的风险.
Ⅲ.草酸(H2C2O4)具有较强的还原性.回答下列问题:
(1)该活动小组的同学取m g菠菜样品在研钵中研磨成汁,用足量热的稀硫酸溶液浸泡,最后过滤(填操作名称)得到澄清溶液.
(2)将溶液转入容量瓶中并加水配制成250mL溶液A.
(3)用滴定法测定草酸盐的含量.
①量取待测溶液A 20.00mL于锥形瓶中,置于铁架台的白纸上.
②用酸式滴定管(填仪器名称)盛装0.1000mol/LKMnO4标准溶液进行滴定时:眼睛注视锥形瓶中溶液颜色变化;当溶液由无色变红,且30s内不恢复原色时,停止滴定,并记录KMnO4标准溶液的终读数.重复滴定3次.
(4)KMnO4滴定待测溶液A时发生反应的离子方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,根据下表实验数据计算菠菜中草酸盐
(以C2O42-计算)的质量分数为(可以只列式不化简)$\frac{5.5g}{mg}$×100%.
(5)下列操作会使测定结果偏高的是CD.
A.配制溶液时未洗涤烧杯和玻璃棒 B.锥形瓶未干燥就直接加入待测液
C.未用标准液润洗盛装标准液的仪器就加入标准液开始滴定
D.滴定前尖嘴处有气泡滴定后气泡消失 E.滴定后俯视读数.
Ⅰ.菠菜中富含可溶性草酸盐,易与豆腐中的钙盐形成不溶于水能溶于稀硫酸的草酸钙(CaC2O4)
Ⅱ.有关专家建议食用高草酸蔬菜的同时,适当摄入高钙食物,使二者在肠道内结合成草酸钙沉淀,并随着大便排出体外.以免草酸进入血液中与人体内的血钙结合,形成血液中的草酸钙需经肝脏、肾脏、尿道,随着小便排出体外,大量草酸钙流经肾脏,提升了泌尿系统结石的风险.
Ⅲ.草酸(H2C2O4)具有较强的还原性.回答下列问题:
(1)该活动小组的同学取m g菠菜样品在研钵中研磨成汁,用足量热的稀硫酸溶液浸泡,最后过滤(填操作名称)得到澄清溶液.
(2)将溶液转入容量瓶中并加水配制成250mL溶液A.
(3)用滴定法测定草酸盐的含量.
①量取待测溶液A 20.00mL于锥形瓶中,置于铁架台的白纸上.
②用酸式滴定管(填仪器名称)盛装0.1000mol/LKMnO4标准溶液进行滴定时:眼睛注视锥形瓶中溶液颜色变化;当溶液由无色变红,且30s内不恢复原色时,停止滴定,并记录KMnO4标准溶液的终读数.重复滴定3次.
(4)KMnO4滴定待测溶液A时发生反应的离子方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,根据下表实验数据计算菠菜中草酸盐
(以C2O42-计算)的质量分数为(可以只列式不化简)$\frac{5.5g}{mg}$×100%.
| 滴定次数 | 待测溶液A的体积(mL) | KMnO4标准溶液的体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.10 | 20.12 |
| 第二次 | 20.00 | 2.20 | 24.20 |
| 第三次 | 20.00 | 4.30 | 24.28 |
A.配制溶液时未洗涤烧杯和玻璃棒 B.锥形瓶未干燥就直接加入待测液
C.未用标准液润洗盛装标准液的仪器就加入标准液开始滴定
D.滴定前尖嘴处有气泡滴定后气泡消失 E.滴定后俯视读数.
20.将2mol/L HCN溶液和1mol/L NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是( )
| A. | c(HCN)>c(CN-) | B. | c(Na+)<c(CN-) | ||
| C. | c(HCN)-c(CN-)=c(OH-) | D. | c(HCN)+c(CN-)=2 mol/L |
7.常温下,将某一元酸HA和NaOH溶液等体积混合,混合后所得溶液的pH如下表:
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来判断HA是强酸还是弱酸:若a=7,则说明HA为强酸;若a>7,则说明HA为弱酸.
(2)试表示出甲组混合液中的电荷守恒关系c(H+)+c(Na+)=c(OH-)+c(A-)
(3)单从乙组情况分析,若HA是弱酸,则C1>0.2mol/L(填“>”“<”“=”).此时混合溶液中c(A-)=c(Na+)(填“>”“<”“=”)
(4)丙组实验所得混合溶液中由水电离出的c(OH-)=10-4mol/L.
| 实验编号 | HA的浓度(mol/L) | NaOH的浓度(mol/L) | 混合溶液的PH |
| 甲 | 0.2 | 0.2 | PH=a |
| 乙 | C1 | 0.2 | PH=7 |
| 丙 | 0.1 | 0.1 | PH=10 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来判断HA是强酸还是弱酸:若a=7,则说明HA为强酸;若a>7,则说明HA为弱酸.
(2)试表示出甲组混合液中的电荷守恒关系c(H+)+c(Na+)=c(OH-)+c(A-)
(3)单从乙组情况分析,若HA是弱酸,则C1>0.2mol/L(填“>”“<”“=”).此时混合溶液中c(A-)=c(Na+)(填“>”“<”“=”)
(4)丙组实验所得混合溶液中由水电离出的c(OH-)=10-4mol/L.
4.某溶液能溶解Al(OH)3固体,则此溶液中一定能大量共存的离子组是( )
| A. | Mg2+、Cl-、Na+、NO3- | B. | K+、Na+、NO3-、HCO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、Na+、AlO2-、SO42- |
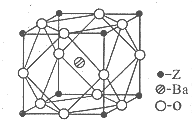 A、B、C、D、Z为周期表前四周期元素,原子序数依次递增,已知:
A、B、C、D、Z为周期表前四周期元素,原子序数依次递增,已知: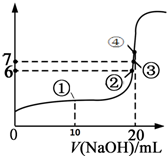 25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题:
25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题: