题目内容
19. 锌是一种重要的金属,锌及其化合物有着广泛的应用.
锌是一种重要的金属,锌及其化合物有着广泛的应用.①锌在元素周期表中的位置是:第四周期第ⅡB族.
②葡萄糖酸锌[CH2OH(CHOH)4 COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式1s22s22p63s23p63d10或[Ar]3d10,葡萄糖分子[CH2OH(CHOH)4CHO]中碳原子杂化方式有sp2、sp3.
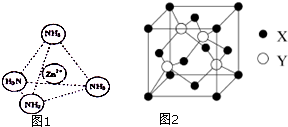
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子属于极性分子(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图1中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键.
④图2示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的Zn与X的原子个数之比为1:1;
⑤在④的晶胞(图2)中,如果只考查X的排列方式,则X的堆积方式属于金属晶体堆积方式中的面心立方最密堆积;设该晶胞中Zn的半径为r1 cm,其相对原子质量为M1,X的半径为r2cm,其相对原子质量为M2,则该晶体的密度为$\frac{3\sqrt{3}({M}_{1}+{M}_{2})}{16{N}_{A}({r}_{1}+{r}_{2})^{3}}$g/cm3(写出含有字母的表达式).
分析 ①Zn的原子序数是30,在第四周期第ⅡB 族;
②葡萄糖里有两种碳原子,葡萄糖是无羟基醛,所以,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳);
③同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子;[Zn(NH3)4]2+中Zn2+与N之间的化学键是配位键;
④利用均摊法可计算出晶胞中原子个数,据此得出原子个数比;
⑤根据晶胞结构图可知,X原子分布在晶胞立方体的顶点和面心上,是面心立方最密堆积,根据$ρ=\frac{m}{V}$,可算出密度.
解答 解:①Zn的原子序数是30,其电子排布式为:1s22s22p63s23p63d104s2,由电子排布式可知该元素为第四周期第ⅡB族,故答案为:第四周期第ⅡB族;
②Zn2+基态电子排布式为:1s22s22p63s23p63d10或[Ar]3d10 ,葡萄糖里有两种碳原子,葡萄糖是无羟基醛,所以,一种是以sp3杂化(接羟基的碳),一种是以sp2杂化(醛基里的碳),
故答案为:1s22s22p63s23p63d10或[Ar]3d10;sp2、sp3;
③配位体NH3分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,是极性分子;[Zn(NH3)4]2+中Zn2+与N之间的化学键是配位键,
故答案为:极性分子;  ;
;
④根据晶胞结构图可知,晶胞中锌的个数为4,X的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以锌原子与X原子的个数比为1:1,故答案为:1:1;
⑤根据晶胞结构图可知,X原子分布在晶胞立方体的顶点和面心上,是面心立方最密堆积,在每个晶胞中含有4个锌原子和4个X原子,在晶胞结构中,晶胞的体对角线长度为4(r1+r2),所以晶胞的边长为$\frac{4({r}_{1}+{r}_{2})}{\sqrt{3}}$,根据$ρ=\frac{m}{V}$,可知密度为$\frac{\frac{4({M}_{1}+{M}_{2})}{{N}_{A}}}{[\frac{4({r}_{1}+{r}_{2})}{\sqrt{3}}]^{3}}$g/cm3=$\frac{3\sqrt{3}({M}_{1}+{M}_{2})}{16{N}_{A}({r}_{1}+{r}_{2})^{3}}$g/cm3,故答案为:面心立方最密;$\frac{3\sqrt{3}({M}_{1}+{M}_{2})}{16{N}_{A}({r}_{1}+{r}_{2})^{3}}$.
点评 本题考查元素位置、核外电子排布式的书写、极性分子、晶胞的计算、原子轨道杂化方式及杂化类型判断、晶体类型的判断等,难度较大,掌握晶胞的计算是解题的关键

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案| A. | 丙烯分子有7个σ键,1个π键 | |
| B. | 由2H和18O所组成的水11g,其中所含的中子数为4NA | |
| C. | 0.1mol SiO2晶体中所含有的硅氧键数目为0.2NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为5NA个 |
①NH3的熔、沸点比VA族其他元素氢化物的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定.
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
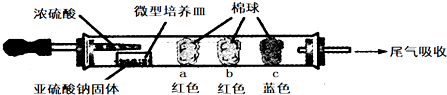
请填写表中的空白:
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: 2OHˉ+SO2=SO32ˉ+H2O 或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 结论:该气体具有还原 性 |

| A. | DCHP的分子式为C20H26O4 | |
| B. | 环己醇分子中所有碳原子不可能共平面 | |
| C. | DCHP的一氯取代物有5种 | |
| D. | DCHP通过取代反应可以得到环已醇 |
 海洋中的珊瑚虫经如下反应形成石灰石外壳,进而形成珊瑚:Ca2++2HCO3-?CaCO3+H2O+CO2.与珊瑚虫共生的藻类会消耗海洋中的CO2.气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡.下列说法不合理的是( )
海洋中的珊瑚虫经如下反应形成石灰石外壳,进而形成珊瑚:Ca2++2HCO3-?CaCO3+H2O+CO2.与珊瑚虫共生的藻类会消耗海洋中的CO2.气候变暖、温室效应的加剧干扰了珊瑚虫的生长,甚至致其死亡.下列说法不合理的是( )| A. | 共生藻类消耗CO2,有利于珊瑚的形成 | |
| B. | 海洋中CO2浓度升高,抑制了珊瑚的形成 | |
| C. | 温度升高会增大CO2在海水中的溶解度,抑制了珊瑚的形成 | |
| D. | 将CO2转化为甲醇等化工原料,有助于缓解温室效应 |
| A. | 乙醇用作医用消毒剂时,无水乙醇消毒效果最好 | |
| B. | 高锰酸钾溶液可以杀死埃博拉病毒,其消毒原理与漂白粉消毒饮用水的原理不同 | |
| C. | 公益调查《柴静雾霾调查:穹顶之下》发布,其中雾霾中的PM2.5属于胶体 | |
| D. | 天津港爆炸案中对剧毒的氰化钠(NaCN) 喷洒双氧水处理,利用了双氧水的氧化性 |