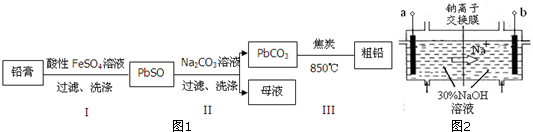
题目内容
14.硬质玻璃管进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.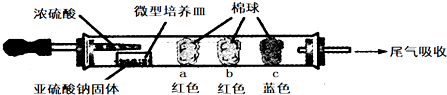
请填写表中的空白:
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: 2OHˉ+SO2=SO32ˉ+H2O 或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 结论:该气体具有还原 性 |
分析 a、二氧化硫具有漂白性使品红褪色,加热恢复红色;
b、碱溶液中滴入酚酞变红色,二氧化硫是酸性氧化物和碱反应,红色褪去;
c、碘单质遇淀粉变蓝,二氧化硫在水溶液中被碘单质氧化为硫酸,碘单质被还原为碘离子.
解答 解:a.红色棉球变白,微热后又恢复红色,说明二氧化硫使品红溶液褪色,则棉球上滴有品红溶液,该实验说明二氧化硫具有漂白性,但其漂白性不稳定,
b.二氧化硫属于酸性氧化物,能和NaOH溶液反应生成亚硫酸钠和水或亚硫酸氢钠,导致溶液碱性减弱,所以棉球变为白色,离子方程式为:SO2+2OH-=SO32-+H2O或OHˉ+SO2=HSO3ˉ;
c.碘遇淀粉试液变蓝色,二氧化硫具有还原性,碘具有氧化性,二者反应生成氢碘酸和硫酸,所以棉球变为白色,离子方程式为:SO2+I2+2H2O=4H++SO42-+2I-,该实验说明二氧化硫具有还原性,
故答案为:
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | ||
| b | 离子方程式:2OHˉ+SO2=SO32ˉ+H2O 或OHˉ+SO2=HSO3- | ||
| c | 含淀粉的碘水 | 还原 |
点评 本题考查了二氧化硫的还原性、氧化性和漂白性,根据二氧化硫的这几个性质分析解答,同时考查学生分析问题、解决问题的能力,题目难度中等.

练习册系列答案
相关题目
5.如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
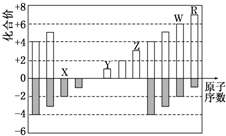

| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:R>W | |
| C. | WX3和水反应形成的化合物是离子化合物 | |
| D. | Y和Z两者最高价氧化物对应的水化物的碱性:Y<Z |
2.某陨石中含有镁元素的一种同位素${\;}_{12}^{28}$Mg,下列对该同位素描述正确的是( )
| A. | 质量数为12 | B. | 核电荷数为12 | ||
| C. | 电子数为28 | D. | 中子数与质子数之差为16 |
9.下列各组元素都属于短周期金属元素的是( )
| A. | H C Zn | B. | Li Na Al | C. | Mg Al Si | D. | Na Cl Fe |
3.食盐与生产、生活密切相关,下列说法不正确的是( )
| A. | 工业盐可代替食盐食用 | B. | 加碘食盐添加的是碘酸钾 | ||
| C. | 食盐是侯氏制碱的主要原料之一 | D. | 工业上电解饱和食盐水可制取烧碱 |
4.下列反应能使有机物官能团数目增加的是( )
| A. | 乙烯与HBr发生加成反应 | B. | 苯发生硝化反应 | ||
| C. | 乙烯合成聚乙烯 | D. | 乙醇催化氧化生成乙醛 |
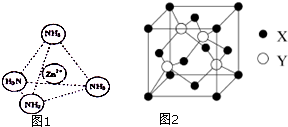 锌是一种重要的金属,锌及其化合物有着广泛的应用.
锌是一种重要的金属,锌及其化合物有着广泛的应用.