题目内容
下列叙述正确的是( )
| A、将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色 |
| B、将一小块钠放入盛有水的烧杯中,钠在水面上游动,同时看到烧杯内的溶液变为红色 |
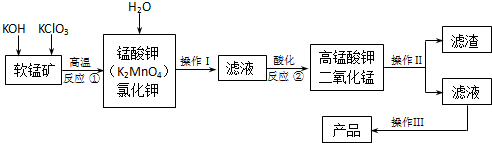
C、 如图,一段时间后给烧杯内的溶液中加入黄色的K3[Fe(CN)6]溶液,可看到Fe电极附近有蓝色沉淀生成 |
| D、向盛有少量Mg(OH)2沉淀悬浊液的试管中滴加氯化铵溶液,可看到沉淀溶解 |
考点:铜金属及其重要化合物的主要性质,原电池和电解池的工作原理,弱电解质在水溶液中的电离平衡,钠的化学性质
专题:基本概念与基本理论
分析:A.铜和浓硫酸在加热条件下反应后生成物以固体形成存在;
B.钠和水反应生成氢氧化钠和氢气;
C.锌为负极,铁为正极;
D.氯化铵促进氢氧化镁的电离.
B.钠和水反应生成氢氧化钠和氢气;
C.锌为负极,铁为正极;
D.氯化铵促进氢氧化镁的电离.
解答:
解:A.Cu与浓H2SO4加热反应后溶液不呈蓝色(以固体形式存在),故A错误;
B.Na和水反应生成NaOH加入酚酞,溶液变红,如不加酚酞,则溶液无色,故B错误;
C.形成原电池,Zn作负极,所以在Fe电极附近加入K3[Fe(CN)6]不会有蓝色沉淀生成,故C错误;
D.由于Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),OH-+NH4+?NH3?H2O,平衡右移,沉淀溶解,故D正确.
故选D.
B.Na和水反应生成NaOH加入酚酞,溶液变红,如不加酚酞,则溶液无色,故B错误;
C.形成原电池,Zn作负极,所以在Fe电极附近加入K3[Fe(CN)6]不会有蓝色沉淀生成,故C错误;
D.由于Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),OH-+NH4+?NH3?H2O,平衡右移,沉淀溶解,故D正确.
故选D.
点评:本题主要考查较为综合,涉及元素化合物以及原电池知识,为高频考点,侧重于学生的分析能力,易错点为A和D,掌握氯化铵溶液呈酸性,Mg(OH)2的悬浊液中加入NH4Cl溶液实质为NH4+结合OH-是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
对于常温下pH为4的氯化铵溶液与醋酸溶液,下列叙述正确的是( )
| A、溶液中c(H+)相等 |
| B、水电离的c(H+)相等 |
| C、两溶液中水的电离程度相等 |
| D、醋酸溶液中水电离的c(H+)多 |
 X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )①C、CO ②AlCl3、Al(OH)3 ③Na、Na2O ④NaOH、Na2CO3.
| A、①②③ | B、①② |
| C、③④ | D、①②③④ |
下列物质的鉴别方法正确的是( )
| A、用澄清石灰水鉴别氢气和一氧化碳 |
| B、用无色酚酞鉴别碳酸钠溶液和氢氧化钠溶液 |
| C、用食盐水鉴别硬水和软水 |
| D、用水鉴别硝酸铵固体和氢氧化钠固体 |
除去括号内杂质所用试剂和方法,正确的是( )
| A、乙醇(乙酸) NaOH溶液 分液 |
| B、乙烯(SO2) KMnO4溶液 洗气 |
| C、乙烷(乙烯) H2(催化剂) 催化加氢 |
| D、乙醇(水) CaO 蒸馏 |
下列关于酸碱中和滴定的说法中,正确的是( )
| A、石蕊可作为判断终点的指示剂 |
| B、滴定时,控制滴加速率:先快后慢 |
| C、标准溶液的浓度越大,滴定误差越小 |
| D、滴定时,眼睛注视滴定管内液面的变化 |



 化学反应3A2(g)+C2(g)?2CA3(g).当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),如图是反应速率与时间的关系图,其中表示平衡混合物中CA3含量最高的一段时间是
化学反应3A2(g)+C2(g)?2CA3(g).当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),如图是反应速率与时间的关系图,其中表示平衡混合物中CA3含量最高的一段时间是