题目内容
7.下列微粒中,①NaF、②H2O2、③NH4Cl、④O2、⑤KOH、⑥CO2、⑦CCl4、⑧MgCl2、⑨Br2⑩Ne,即含有极性键又含有非极性键的物质是②,既含有共价键又含有离子键的物质是③⑤.属于离子化合物的是①③⑤⑧.属于共价化合物的是②⑥⑦.分析 一般来说活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性共价键,同种非金属元素之间易形成非极性共价键,单原子分子中不含化学键;
只含共价键的化合物是共价化合物;
含有离子键的化合物是离子化合物,离子化合物中可能含有共价键.
解答 解:①NaF中钠离子和氟离子之间只存在离子键,为离子化合物;
②H2O2中氢原子与氧原子之间存在极性共价键,氧原子与氧原子之间存在非极性共价键,属于共价化合物;
③NH4Cl中铵根离子和氯离子之间存在离子键、氮原子和氢原子之间存在极性共价键,为离子化合物;
④O2中氧原子和氧原子之间存在非极性共价键,属于单质;
⑤KOH中钾离子和氢氧根离子之间存在离子键、氧原子和氢原子之间存在极性共价键,为离子化合物;
⑥CO2中氧原子和氧原子之间存在极性共价键,属于共价化合物;
⑦CCl4中碳原子和氯原子之间存在极性共价键,属于共价化合物;
⑧MgCl2中镁离子和氯离子之间只存在离子键,为离子化合物;
⑨Br2中溴原子和溴原子之间存在非极性共价键,属于单质;
⑩Ne中没有化学键;
故答案为:②;③⑤;①③⑤⑧;②⑥⑦.
点评 本题考查了物质和化学键的关系,根据物质的构成微粒确定化学键,知道离子键和共价键的区别,注意稀有气体中不存在化学键,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.下列电离方程式书写正确的是( )
| A. | H2SO4═H22++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Ba(OH)2═Ba2++2(OH)- | D. | Na3PO4═3Na++PO43- |
18.下列氯元素含氧酸酸性最强的是( )
| A. | HClO | B. | HClO2 | C. | HClO3 | D. | HClO4 |
15.下列除杂的方法错误的是( )
| 物质 | 杂质 | 除杂试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | Mg | Al | NaOH溶液 | 过滤 |
| C | FeCl2 | FeCl3 | Cu | 过滤 |
| D | NaCl | 泥沙 | 加水 | 溶解、过滤、蒸发 |
| A. | A | B. | B | C. | C | D. | D |
19.下列有机物的命名正确的是( )
| A. | 1,2─二甲基戊烷 | B. | 2─乙基戊烷 | C. | 2,3─二甲基戊烷 | D. | 3─甲基己烷 |
16.下列说法中,正确的是( )
| A. | 苯和甲苯都能与卤素单质、硝酸等发生取代反应 | |
| B. | 苯的同系物是分子中仅含有一个苯环的所有烃类物质 | |
| C. | 烯烃在适宜的条件下只能发生加成反应不能发生取代反应 | |
| D. | 分子式是C4H8的烃分子中一定含有碳碳双键 |
17.雷雨天空气中的某些物质之间发生了一系列化学反应,最终产生了氮肥.其中跟下列反应无关的是(反应中的条件未注明,也未配平)( )
| A. | N2+H2→NH3 | B. | N2+O2→NO | C. | NO+O2→NO2 | D. | NO2+H2O→HNO3+NO |
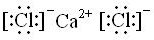 ,属于离子化合物.
,属于离子化合物.