题目内容
3.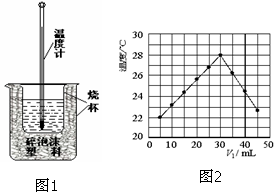 用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和环形玻璃搅拌棒.泡沫塑料的作用是减少热量的损失.
(2)若NaOH溶液用相同浓度和体积的下列溶液代替,则对中和热数值测定结果将如何影响(填“偏大”、“偏小”、“无影响”):KOH溶液无影响;氨水(NH3•H2O)偏小.
(3)某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由题干及图形可知,V1:V2=3:2时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为1.5mol/L.
分析 (1)实验时应避免热量的损失,减小实验误差;
(2)NaOH和KOH都是强碱,但一水合氨为弱碱,电离吸热;
(3)由图象可知恰好完全反应时,温度最高,结合n(NaOH)=n(HCl)计算.
解答 解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满泡沫塑料的作用是减少实验过程中的热量损失;
故答案为:环形玻璃搅拌棒;减少热量的损失;
(2)NaOH和KOH都是强碱,换成KOH对实验无影响,但一水合氨为弱电解质,电离吸热,导致测定结果偏小,故答案为:无影响; 偏小;
(3)由图象可知V1=30mL时温度最高,说明酸碱恰好完全反应,V1+V2=50mL,则V2=20mL,V1:V2=3:2,则有0.03L×1mol/L=0.02L×c,c=1.5mol/L.
故答案为:3:2; 1.5.
点评 本题考查中和热的测定,为高频考点,侧重于考查学生的分析问题的能力,以及利用化学方程式计算的能力,比较综合,要认真分析解答,难度不大.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
13.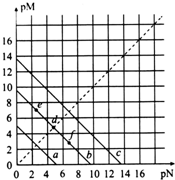 已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )
已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )
 已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )
已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )| A. | a线代表的是PbCO3 | |
| B. | T℃时,向10 mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+):c(Pb2+)=3×10-5 | |
| C. | T℃时,向CaSO4沉淀中加入1 mol/L的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀 | |
| D. | T℃时,向CaCO3悬浊液中加入NH4Cl固体,会使图象中d点向f点转化 |
14.12mL浓度为0.10mol•L-1的Na2SO3溶液,恰好与10mL浓度为0.04mol?L-1的K2Cr2O7溶液完全反应,已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
| A. | +5 | B. | +4 | C. | +3 | D. | +2 |
11.下列关于Fe(OH)3胶体的说法正确的是( )
| A. | Fe(OH)3胶体带正电荷,因此能发生电泳现象 | |
| B. | Fe(OH)3胶体与FeCl3溶液的本质区别是胶体粒子直径在1-100nm之间 | |
| C. | 将FeCl3溶液加入到沸水中能制得Fe(OH)3胶体 | |
| D. | Fe(OH)3胶体和CuSO4溶液都能发生丁达尔现象 |
18.已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:NaCN+HNO2═HCN+NaNO2
NaCN+HF═HCN+NaF
NaNO2+HF═HNO2+NaF
由此可判断下列叙述不正确的是( )
NaCN+HF═HCN+NaF
NaNO2+HF═HNO2+NaF
由此可判断下列叙述不正确的是( )
| A. | K(HF)=7.2×10-4 | |
| B. | K(HNO2)=4.9×10-10 | |
| C. | 根据其中两个反应即可得出三种酸对应的电离常数 | |
| D. | K(HCN)<K(HNO2)<K(HF) |
15.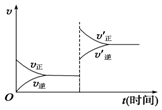 对于达到平衡的可逆反应:X+Y?W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )
对于达到平衡的可逆反应:X+Y?W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )
 对于达到平衡的可逆反应:X+Y?W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )
对于达到平衡的可逆反应:X+Y?W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )| A. | Z、W为气体,X、Y中之一为气体 | B. | Z、W中之一为气体,X、Y为非气体 | ||
| C. | X、Y、Z皆为气体,W为非气体 | D. | X、Y、Z、W皆为气体 |
12.下列离子方程式书写正确的是( )
| A. | 向澄清石灰水中通入足量二氧化碳:OH-+CO2═HCO3- | |
| B. | 氧化钠投入水中发生反应:O2-+H2O═2OH- | |
| C. | 硝酸银溶液中加入铜粉:Ag++Cu═Cu2++Ag | |
| D. | 金属铁溶于稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
10.已知293K时下列物质的溶度积(单位已省略)
下列说法正确的是( )
| Ag2SO4 | FeS | CuS | Ag2S | |
| Ksp | 1.2×10-5 | 6.3×10-18 | 8.5×10-45 | 6.3×10-50 |
| A. | 相同温度下,Ag2SO4、FeS、CuS饱和溶液中:c(Cu2+)>c(Fe2+)>c(Ag+) | |
| B. | 向FeS悬浊液中滴加CuSO4溶液发生反应的离子方程式:S2-+Cu2+=CuS↓ | |
| C. | 浓度均为0.004mol•L-1的AgNO3和H2SO4溶液等体积混合后不能产生沉淀 | |
| D. | 向饱和Ag2S溶液中加少量Na2S固体,溶液中c(Ag+)不变 |