题目内容
用标准盐酸滴定未知浓度的NaOH溶液时,若测定结果偏高,则产生误差的原因可能是( )
| A、滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗 |
| B、酸式滴定管用蒸馏水洗后,用标准盐酸润洗 |
| C、滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失 |
| D、配置NaOH溶液时,NaOH固体中混有少量KOH固体 |
考点:中和滴定
专题:电离平衡与溶液的pH专题
分析:根据c(碱)=
判断不当操作对相关物理量的影响.
| c(酸)×V(酸) |
| V(碱) |
解答:
解:A、盛装未氢氧化钠的锥形瓶用蒸馏水洗过,未用待测液润洗,待测液的物质的量不变,则V(碱)不变,可知c(碱)不变,故A错误;
B、用标准液润洗酸式滴定管,标准液酸的浓度不变,可知c(碱)不变,故B错误;
C、滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失,造成V(酸)偏高,可知c(碱)偏高,故C正确;
D、所用的固体NaOH混有KOH,相同质量的氢氧化钠和氢氧化钾,氢氧化钠的物质的量大于氢氧化钾的物质的量,故所配得溶液的OH-浓度偏小,造成V(酸)偏小,c(碱)偏小,故D错误;
故选C.
B、用标准液润洗酸式滴定管,标准液酸的浓度不变,可知c(碱)不变,故B错误;
C、滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失,造成V(酸)偏高,可知c(碱)偏高,故C正确;
D、所用的固体NaOH混有KOH,相同质量的氢氧化钠和氢氧化钾,氢氧化钠的物质的量大于氢氧化钾的物质的量,故所配得溶液的OH-浓度偏小,造成V(酸)偏小,c(碱)偏小,故D错误;
故选C.
点评:本题考查中和滴定的误差分析,注意利用公式来分析解答,无论哪一种类型的误差,都可以归结为对标准溶液体积的影响,其标准溶液的体积偏小,那么测得的物质的量的浓度也偏小;其标准溶液的体积偏大,那么测得的物质的量的浓度也偏大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
16O中的16表示的含义是( )
| A、氧元素的相对原子质量 |
| B、氧元素的一种同位素的近似相对原子质量 |
| C、氧元素的近似相对原子质量 |
| D、氧元素的一种同位素的质量数 |
下列离子方程式书写正确的是( )
| A、将铁放入氯化铁溶液中:Fe+Fe3+═2Fe2+ |
| B、向新制的氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O |
| C、将少量的二氧化硫通入氢氧化钠溶液中:SO2+2OH-═SO32-+H2O |
| D、向氯化铝溶液中加入过量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ |
下列图示与对应的叙述相符的是( )
A、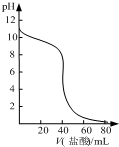 如图表示盐酸滴加到0.1mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂 |
B、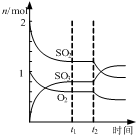 如图表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 |
C、 如图表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
D、 如图表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸 |

 表示(其中X、Y均不为氢):写出符合上述通式且能发生银镜反应的四种物质的结构简式
表示(其中X、Y均不为氢):写出符合上述通式且能发生银镜反应的四种物质的结构简式


 (-R、-R′、-R″表示可能相同或可能不同的原子或原子团)
(-R、-R′、-R″表示可能相同或可能不同的原子或原子团) 有多种同分异构体,符合下列要求的有
有多种同分异构体,符合下列要求的有