题目内容
8.100℃时,向容积为2L的密闭容器中充入一定量的X气体,发生如下反应:X(g)+2Y(g)?Z(g),反应过程中测定的部分数据见下表( )| 反应时间/min | n(X)/mol | n(Y)/mol |
| 0 | 2.00 | 2.40 |
| 10 | 1.00 | |
| 30 | 0.40 |
| A. | 温度为200℃时,上述反应平衡常数为20,则正反应为吸热反应 | |
| B. | 若密闭容器体积可变,其他条件不变,在达到平衡后缩小容器体积为原来一半,则n(X)>1mol/L | |
| C. | 保持其他条件不变,向容器中再充入1.00molX气体和1.20molY气体,到达平衡后,X转化率增大 | |
| D. | 保持其他条件不变,若再向容器中通入0.10molX气体,0.10molY和0.10molZ,则v(正)<v(逆) |
分析 由表格中数据,X(g)+2Y(g)?Z(g)
开始 2 2.4 0
转化 1 2 1
10min 1 0.4 1
可知10min与30min时Y的物质的量相同,10min时达到平衡,100℃时,K=$\frac{0.5mol/L}{0.5mol/L×{(0.2mol/L)}^{2}}$=25,
A.温度为200℃时,上述反应平衡常数为20,小于100℃时K,则升高温度平衡逆向移动;
B.其他条件不变,在达到平衡后缩小容器体积为原来一半,压强增大,平衡正向移动;
C.由上述分析可知,平衡时X为1mol、Y为0.4mol,向容器中再充入1.00molX气体和1.20molY气体,相当于平衡时加Y;
D.若再向容器中通入0.10molX气体,0.10molY和0.10molZ,Qc=$\frac{\frac{1.1mol}{2L}}{\frac{1.1mol}{2L}×{(\frac{0.5mol}{2L})}^{2}}$=16<K.
解答 解:由表格中数据,X(g)+2Y(g)?Z(g)
开始 2 2.4 0
转化 1 2 1
10min 1 0.4 1
可知10min与30min时Y的物质的量相同,10min时达到平衡,100℃时,K=$\frac{0.5mol/L}{0.5mol/L×{(0.2mol/L)}^{2}}$=25,
A.温度为200℃时,上述反应平衡常数为20,小于100℃时K,则升高温度平衡逆向移动,则正反应为放热反应,故A错误;
B.其他条件不变,在达到平衡后缩小容器体积为原来一半,压强增大,平衡正向移动,则n(X)<1mol,故B错误;
C.由上述分析可知,平衡时X为1mol、Y为0.4mol,向容器中再充入1.00molX气体和1.20molY气体,相当于平衡时加Y,平衡正向移动,促进X的转化,达平衡后,X转化率增大,故C正确;
D.若再向容器中通入0.10molX气体,0.10molY和0.10molZ,Qc=$\frac{\frac{1.1mol}{2L}}{\frac{1.1mol}{2L}×{(\frac{0.5mol}{2L})}^{2}}$=16<K,则平衡正向移动,可知v(正)>v(逆),故D错误;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握表格数据的应用、K的计算、平衡移动为解答的关键,侧重分析与计算能力的考查,注意选项D为解答的难点,题目难度不大.

| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
五种固体物质A、B、C、 D、E由下表中不同的阴阳离子组成,它们均易溶于水。
D、E由下表中不同的阴阳离子组成,它们均易溶于水。
阳离子 | Na+ | Al3+ | Fe3+ | Cu2+ | Ba2+ |
阴离子 | OH- | Cl- | CO32- | NO3- | SO42- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片 不溶解,再滴加1.6 mol/L稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
不溶解,再滴加1.6 mol/L稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A的化学式为:A ;
(2)写出步骤②中发生反应的离子方程式 。
(3)D溶液中滴入石蕊试液,现象是 ,原因是 (用离子方程式说明)。
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是 mL。


 $\stackrel{自动失水}{→}$
$\stackrel{自动失水}{→}$ +H2O
+H2O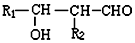
 ;G:(CH2OH)3CCHO.
;G:(CH2OH)3CCHO. .
. .
. (写一种).
(写一种).
 C(s)+H2O(g)。初始时加入平均相对分子质量为15的H2、CO混合气,一段时间后测得气体的平均相对分子质量为16,下列说法中不正确的是( )
C(s)+H2O(g)。初始时加入平均相对分子质量为15的H2、CO混合气,一段时间后测得气体的平均相对分子质量为16,下列说法中不正确的是( )