题目内容
3.有机物M可发生如下所示转化:
已知:
①B在质谱分析中,质荷比最大的为32,在核磁共振氢谱分析中,有吸收峰面积之比为3:1的两个吸收峰.
②两个-OH同时连在一个C原子上,结构不稳定,会自动失水,如:
 $\stackrel{自动失水}{→}$
$\stackrel{自动失水}{→}$ +H2O
+H2O③R1-CHO+R2-CH2-CHO$\stackrel{一定条件}{→}$
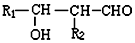
(1)E中官能团名称为羟基、羧基.
(2)①、③的反应类型:①水解反应或取代反应,③加成反应.
(3)写出M、G的结构简式:M:
 ;G:(CH2OH)3CCHO.
;G:(CH2OH)3CCHO.(4)写出A→D的化学反应方程式:
 .
.(5)写出对苯二甲酸与乙二醇反应生成聚对苯二甲酸乙二酯(PET)的化学反应方程式:
 .
.(6)符合下列条件的E的同分异构体有13种,写出其中核磁共振氢谱有五组峰,峰面积之比为1:1:2:2:2的同分异构体的结构简式为
 (写一种).
(写一种).①能发生水解反应 ②能发生银镜反应 ③遇FeCl3溶液显紫色.
分析 M和氢氧化钠的水溶液发生水解反应生成A、B,可说明M含有酯基.B与氧气在Cu、加热条件下发生催化氧化生成F,B中含有羟基,由E可知B含有1个C原子,故B为CH3OH、F为HCHO,F与乙醛反应得到G,结合C的结构简式可知G为(CH2OH)3CCHO.可知A中含有羧基,而A能与新制氢氧化铜反应得到D,则A中含有-CHO,A酸化后与氢气反应生成E,E氧化得到对苯二甲酸,而D酸化也得到对苯二甲酸,可推知A为 ,则E为
,则E为 ,D为
,D为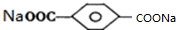 ,由于两个-OH同时连在一个C原子上,结构不稳定,会自动失水,综上分析可知M的结构简式为
,由于两个-OH同时连在一个C原子上,结构不稳定,会自动失水,综上分析可知M的结构简式为 ,以此解答该题.
,以此解答该题.
解答 解:(1)E为 ,含有羟基、羧基等官能团,故答案为:羟基、羧基;
,含有羟基、羧基等官能团,故答案为:羟基、羧基;
(2)反应①属于水解反应,也属于取代反应,反应③属于加成反应,故答案为:水解反应或取代反应;加成反应;
(3)由上述分析可知,M的结构简式为 ,G为(CH2OH)3CCHO,故答案为:
,G为(CH2OH)3CCHO,故答案为: ;(CH2OH)3CCHO;
;(CH2OH)3CCHO;
(4)A→D的化学方程式为 ,
,
故答案为: ;
;
(5)对苯二甲酸与乙二醇反应生成聚对苯二甲酸乙二酯(PET)的化学反应方程式为 ,
,
故答案为: ;
;
(6)E为 ,E的同分异构体符合下列条件①能发生水解反应说明含有酯基,②能发生银镜反应说明含有醛基,③遇FeCl3溶液显紫色说明含有酚羟基,
,E的同分异构体符合下列条件①能发生水解反应说明含有酯基,②能发生银镜反应说明含有醛基,③遇FeCl3溶液显紫色说明含有酚羟基,
则该物质中含有甲酸酯基,如果含有HCOO-、酚-OH和甲基,
如果-OH和-CH3位于相邻位置,有4种;
如果-OH和-CH3位于相间位置,有4种;
如果-OH和-CH3位于相对位置,2种;
如果含有HCOOCH2-、酚-OH,有3种;
所以符合条件的有13种;
其中核磁共振氢谱有五组峰,峰面积之比为1:1:2:2:2的同分异构体的结构简式为 (其中一种),
(其中一种),
故答案为:13; (其中一种).
(其中一种).
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,正确推断A的结构是解本题关键,需要学生熟练掌握官能团的性质与转化,采取正逆推法相结合进行分析,难点是(6)题同分异构体种类判断,要考虑碳链异构、位置异构.

| A. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| B. | 24Cr原子的电子排布式是1s22s22p63s23p63d44s2 | |
| C. | 若某基态原子的外围电子排布为4d25s2,它是第五周期IVB族元素 | |
| D. | M层全充满而N层为4s1的原子和位于第四周期第ⅠA族的原子是同一种元素 |
| A. | CCl4和SiC都属于有机物 | |
| B. | 甲醇和乙酸均能与金属钠反应 | |
| C. | C3H6Cl2的同分异构体有3种 | |
| D. | 若分子式为C5H10O2的酯的水解产物之一为乙醇,则该酯的结构有2种 |
| 反应时间/min | n(X)/mol | n(Y)/mol |
| 0 | 2.00 | 2.40 |
| 10 | 1.00 | |
| 30 | 0.40 |
| A. | 温度为200℃时,上述反应平衡常数为20,则正反应为吸热反应 | |
| B. | 若密闭容器体积可变,其他条件不变,在达到平衡后缩小容器体积为原来一半,则n(X)>1mol/L | |
| C. | 保持其他条件不变,向容器中再充入1.00molX气体和1.20molY气体,到达平衡后,X转化率增大 | |
| D. | 保持其他条件不变,若再向容器中通入0.10molX气体,0.10molY和0.10molZ,则v(正)<v(逆) |
某化学兴趣小组的同学们对SO2与漂粉精、过氧化钠的反应进行实验探究:
【实验I】SO2与漂粉精反应。
操作 | 现象 |
取4g 漂粉精固体,加入100mL 水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
| 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的反应中氧化剂与还原剂的物质的量之比为__________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是____________。
(3)兴趣小组将A中产生的白雾引出导入硝酸酸化的AgN03溶液中,有沉淀产生,据此判断白雾成分为HCl小液滴,该结论合理吗?____________请说明理由____________________。
(4)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。该反应的离子方程式为______________。
(5)①将A瓶中混合物过滤、洗涤,得到沉淀X,X的成分是____________(填化学式);
② 用离子方程式解释现象3中黄绿色褪去的原因____________________。
【实验II】SO2与过氧化钠反应。将一定量(过量)SO2充入注射器X中,硬质玻璃管Y中加入少量过氧化钠,两端用夹子K1、K2夹好。在室温下按图示装置进行实验,请填写空白。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中(假设充分反应) | (1)_______ | (2)反应的化学方程式:_________________ |
将注射器活塞退回原处并固定,待装置恢复到室温,打开K2 | (3)________ | (4)不用解释 |
下列有关实验事实的解释中正确的是
选项 | 问题 | 解释 |
A | 实验室不能配制含有Fe3+、MnO4-、SO42-、Ba2+的中性溶液 | Fe3+水解呈酸性 |
B |
| 含有Ag+的溶液必然含有NO3-,在酸性条件下,可氧化Fe2+ |
C | 将氨气通入水中,形成的水溶液能导电 | 氨气是电解质 |
D | 在FeBr2溶液中通入过量Cl2,溶液变为棕黄色 | 发生反应2Fe2++Cl2===2Fe3++2Cl- |

 +Br2+H2O―→SO
+Br2+H2O―→SO +2Br-+2H+。某溶液中可能含有Na+、NH
+2Br-+2H+。某溶液中可能含有Na+、NH 、Fe2+、K+、Br-、SO
、Fe2+、K+、Br-、SO

 含有H+、Fe2+的溶液中不能大量存在Ag+
含有H+、Fe2+的溶液中不能大量存在Ag+