题目内容
20.下列实验装置图正确且能达到实验目的是( )| A. | 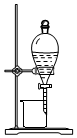 如图所示装置可从碘的CCl4溶液中分离出碘 | |
| B. | 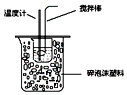 如图所示装置可用于在实验室测定中和反应的反应热 | |
| C. | 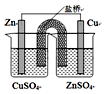 如图所示装置能构成锌铜原电池 | |
| D. | 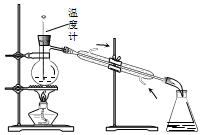 如图所示装置可用于实验室中分馏石油 |
分析 A.碘的CCl4溶液互溶,但沸点不同;
B.温度计测定温度,泡沫和硬纸板可隔热,搅拌器搅拌液体;
C.左侧烧杯发生化学反应,不能构成原电池;
D.蒸馏时温度计测定馏分的温度.
解答 解:A.碘的CCl4溶液互溶,但沸点不同,不能分液分离,应选蒸馏法,故A错误;
B.温度计测定温度,泡沫和硬纸板可隔热,搅拌器搅拌液体,则图中装置可测定中和热,故B正确;
C.左侧烧杯发生化学反应,不能构成原电池,应将电解质互换,故C错误;
D.蒸馏时温度计测定馏分的温度,温度计的水银球应在烧瓶的支管口处,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、中和热测定、原电池、实验装置的作用、实验技能为解答本题的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
11.下列热化学方程式正确的是(△H的绝对值均正确)( )
| A. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1(燃烧热) | |
| B. | OH-(aq)+H+(aq)=H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | 2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1(反应热) | |
| D. | 2NO2=O2+2NO△H=+116.2 kJ•mol-1(反应热) |
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | FeCl3溶液中:K+、Na+、SO42-、SCN- | |
| B. | 在强碱性溶液中:K+、Na+、CO3-、AlO2- | |
| C. | 在盐酸溶液中:K+、Fe2+、SO32-、NO3- | |
| D. | 与铝反应产生氢气的溶液中:Na+、K+、HCO3-、Cl- |
12.决定物质性质的重要因素是物质结构.请回答下列问题.
(1)已知A和B为第三周期元素,其原子第一至第四电离如表所示:
A通常显+3价,A的第一电离能小于B的第一电离能的原因.
(2)PCl3的空间构型为,中心原子的杂化类型为sp3杂化.
(3)某化合物的分子结构如图所示,接受孤电子对的成键原子基态的核外电子排布式为.其分子内不含有AC(填字母).

A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键
(4)氮化铝具有耐高温、抗冲击、导热性好等优良性质,氮化硼与氮化铝晶体类型相同,氮化硼的熔点比氮化铝高 (填高或低),可能的原因是氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B-N键键能大于Al-N键键能.
(5)若氮化铝的密度为pgcm-3,则晶体中最近的两个A1原子的距离为$\frac{\sqrt{2}}{2}•\root{3}{\frac{164}{ρ•{N}_{A}}}$cm.(阿伏伽德罗常数的值用NA表示)
(1)已知A和B为第三周期元素,其原子第一至第四电离如表所示:
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(2)PCl3的空间构型为,中心原子的杂化类型为sp3杂化.
(3)某化合物的分子结构如图所示,接受孤电子对的成键原子基态的核外电子排布式为.其分子内不含有AC(填字母).

A.离子键 B.极性键 C.金属键 D.配位键 E.氢键 F.非极性键
(4)氮化铝具有耐高温、抗冲击、导热性好等优良性质,氮化硼与氮化铝晶体类型相同,氮化硼的熔点比氮化铝高 (填高或低),可能的原因是氮化硼与氮化铝均为原子晶体,且硼原子半径小于铝原子半径,B-N键键能大于Al-N键键能.
(5)若氮化铝的密度为pgcm-3,则晶体中最近的两个A1原子的距离为$\frac{\sqrt{2}}{2}•\root{3}{\frac{164}{ρ•{N}_{A}}}$cm.(阿伏伽德罗常数的值用NA表示)
9.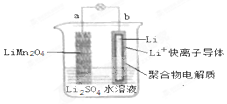 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )
 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )| A. | a 为电池的正极 | |
| B. | 电池充电反应为 LiMn2O4=Li1-xMn2O4+xLi | |
| C. | 放电时,a 极锂的化合价发生变化 | |
| D. | 放电时,溶液中 Li+从 b 向 a 迁移 |
10.为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验.
(1)配制50mL 1.0mol•L-1的FeCl3溶液,测其pH约为0.7,即c(H+)=0.2mol•L-1.
①用化学用语解释FeCl3溶液呈酸性的原因:Fe3++3H2O?Fe(OH)3+3H+.
②下列实验方案中,能使FeCl3溶液pH升高的是acd(填字母序号).
a.加水稀释 b.加入FeCl3固体 c.滴加浓KSCN溶液 d.加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应.实验操作及现象如表:
已知:Zn的性质与Al相似,能发生反应:Zn+2NaOH═Na2ZnO2+H2↑
①结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:溶液温度升高,反应过程中出现H2使溶液中c(H+)降低,都会促进Fe3++3H2O?Fe(OH)3+3H+正向移动,出现红褐色Fe(OH)3沉淀.
②用离子方程式解释反应后溶液为浅绿色的原因:2Fe3++Zn═2Fe2++Zn2+.
③分离出黑色固体,经下列实验证实了其中含有的主要物质.
i.黑色固体可以被磁铁吸引;
ii.向黑色固体中加入足量的NaOH溶液,产生气泡;
iii.将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv.向iii反应后的溶液中滴加KSCN溶液,无变化.
a.黑色固体中一定含有的物质是Fe和Zn.
b.小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是iii中,若存在Fe3O4,稀盐酸与Fe3O4反应产生的Fe3+可与Fe继续反应生成Fe2+,导致在iv中检测不到Fe3+,与没有Fe3O4得到的iv中现象相同.
(3)为进一步探究上述1.0mol•L-1FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
小组同学得出结论:在1.0mol•L-1FeCl3溶液中,Fe3+的氧化性比H+更强.
(1)配制50mL 1.0mol•L-1的FeCl3溶液,测其pH约为0.7,即c(H+)=0.2mol•L-1.
①用化学用语解释FeCl3溶液呈酸性的原因:Fe3++3H2O?Fe(OH)3+3H+.
②下列实验方案中,能使FeCl3溶液pH升高的是acd(填字母序号).
a.加水稀释 b.加入FeCl3固体 c.滴加浓KSCN溶液 d.加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应.实验操作及现象如表:
| 操作 | 现象 |
| 向反应瓶中加入6.5g锌粉,然后加入50mL 1.0mol•L-1的FeCl3溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
| 收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
①结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:溶液温度升高,反应过程中出现H2使溶液中c(H+)降低,都会促进Fe3++3H2O?Fe(OH)3+3H+正向移动,出现红褐色Fe(OH)3沉淀.
②用离子方程式解释反应后溶液为浅绿色的原因:2Fe3++Zn═2Fe2++Zn2+.
③分离出黑色固体,经下列实验证实了其中含有的主要物质.
i.黑色固体可以被磁铁吸引;
ii.向黑色固体中加入足量的NaOH溶液,产生气泡;
iii.将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv.向iii反应后的溶液中滴加KSCN溶液,无变化.
a.黑色固体中一定含有的物质是Fe和Zn.
b.小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是iii中,若存在Fe3O4,稀盐酸与Fe3O4反应产生的Fe3+可与Fe继续反应生成Fe2+,导致在iv中检测不到Fe3+,与没有Fe3O4得到的iv中现象相同.
(3)为进一步探究上述1.0mol•L-1FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如表:
| 操作 | 现象 |
| 将5mL 1.0mol•L-1的FeCl3溶液与0.65g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
| 将5 mL 0.2 mol•L-1(或pH=0.7)的盐酸与0.65g锌粉混合 | 溶液中立即产生大量气泡 |

 +3Br2→
+3Br2→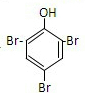 +3HBr
+3HBr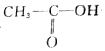 +H-O-CH2CH3$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O
+H-O-CH2CH3$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O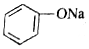 +CO2+H2O→C6H5OH+NaHCO3.
+CO2+H2O→C6H5OH+NaHCO3.