题目内容
1.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,下列判断正确的是( )
| A. | K闭合时,c电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42- | |
| B. | 当电路中转移0.4mol电子时,I中消耗的H2SO4为0.2 mol | |
| C. | K闭合时,II中SO42-向c电极迁移 | |
| D. | K闭合一段时间后,II可单独作为电源,d电极为正极 |
分析 K闭合时,Ⅰ池是原电池,负极上铅失电子发生氧化反应,则b为负极,正极上二氧化铅得电子发生还原反应,则a为正极;Ⅱ池为电解池,d与原电池的正极相连,为阳极;阳极上硫酸铅失电子发生氧化反应,c为阴极,阴极上PbSO4得电子生成Pb;K闭合一段时间后,在Ⅱ中d上生成PbO2,c为Pb,则形成原电池时,PbO2作正极,据此分析.
解答 解:K闭合时,Ⅰ池是原电池,负极上铅失电子发生氧化反应,则b为负极,正极上二氧化铅得电子发生还原反应,则a为正极;Ⅱ池为电解池,d与原电池的正极相连,为阳极;阳极上硫酸铅失电子发生氧化反应,c为阴极,阴极上PbSO4得电子生成Pb;K闭合一段时间后,在Ⅱ中d上生成PbO2,c为Pb,则形成原电池时,PbO2作正极,
A.K闭合时,c为阴极,阴极上PbSO4得电子生成Pb,则c电极反应式:PbSO4+2e-=Pb+SO42-,故A错误;
B.当电路中转移0.4mol电子时,由电池反应Pb+PbO2+2H2SO4═2PbSO4+2H2O可知,I中消耗的H2SO4为0.4 mol,故B错误;
C.K闭合时,II中SO42-向阳极移动,即向d电极迁移,故C错误;
D.K闭合一段时间后,在Ⅱ中d上生成PbO2,c为Pb,则形成原电池时,Pb为负极,PbO2作正极,即d为正极,故D正确.
故选D.
点评 本题考查了原电池和电解池原理的分析应用,主要是电极反应书写,充电过程中电极的判断是解题关键,题目难度中等,侧重于考查学生的分析能力和对基本原理的应用能力.

练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
12.醋酸是电解质,下列事实能说明醋酸是弱电解质组合的是( )
①醋酸与水能以任意比互溶
②醋酸溶液能导电
③醋酸溶液中存在醋酸分子
④0.1mol•L-1醋酸溶液的pH比0.1mol•L-1盐酸的pH大
⑤醋酸能和碳酸钙反应放出CO2
⑥0.1mol•L-1醋酸钠溶液的pH=8.9
⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸溶液反应,醋酸产生H2的速率慢
⑧0.1mol•L-1醋酸溶液能使紫色石蕊试液变红.
①醋酸与水能以任意比互溶
②醋酸溶液能导电
③醋酸溶液中存在醋酸分子
④0.1mol•L-1醋酸溶液的pH比0.1mol•L-1盐酸的pH大
⑤醋酸能和碳酸钙反应放出CO2
⑥0.1mol•L-1醋酸钠溶液的pH=8.9
⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸溶液反应,醋酸产生H2的速率慢
⑧0.1mol•L-1醋酸溶液能使紫色石蕊试液变红.
| A. | ②⑥⑦⑧ | B. | ③④⑤⑥ | C. | ③④⑥⑦ | D. | ①②⑧ |
9.有两种金属的合金13 g,与足量稀硫酸反应后,在标准状况下产生气体11.2 L,则组成该合金的金属不可能是( )
| A. | Mg和Al | B. | Mg和Zn | C. | Al和Zn | D. | Al和Fe |
16.为了更简便地制取干燥的NH3,适合的方法是( )
| A. | NH4Cl与浓H2SO4混合共热,生成的气体用碱石灰进行干燥 | |
| B. | N2+3H2$?_{高温、高压}^{催化剂}$2NH3,用烧碱进行干燥 | |
| C. | 加热浓氨水,气体用碱石灰干燥 | |
| D. | 加热NH4HCO3,气体用P2O5干燥 |
6.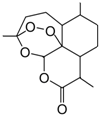 中国女药学家屠呦呦因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖生物学或医学奖.下列有关青蒿素的叙述错误的是( )
中国女药学家屠呦呦因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖生物学或医学奖.下列有关青蒿素的叙述错误的是( )
 中国女药学家屠呦呦因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖生物学或医学奖.下列有关青蒿素的叙述错误的是( )
中国女药学家屠呦呦因创制新型抗疟药---青蒿素(结构如图)和双氢青蒿素的贡献,荣获2015年诺贝尔奖生物学或医学奖.下列有关青蒿素的叙述错误的是( )| A. | 青蒿素的同分异构体中不可能含有既苯环有含有羧基 | |
| B. | 易溶于C2H5OC2H5 | |
| C. | 氧原子化合价有-1和-2 | |
| D. | 能与NaOH溶液反应 |
13.短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示.已知Y和W的原子序数之和是Z的3倍,下列说法正确的是( )
| Y | Z | ||
| X | W |
| A. | 原子半径:X>Z>W | |
| B. | 气态氢化物的稳定性:Y>Z>W | |
| C. | Z、W均可形成含Y元素的离子化合物 | |
| D. | 最高价氧化物对应水化物的酸性:Y>X>W |
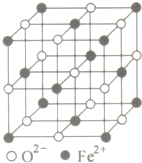 有些食物中铁元素含量非常丰富,其中非血红素铁是其存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
有些食物中铁元素含量非常丰富,其中非血红素铁是其存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.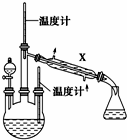 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):CO(NH2)2+2NaOH+NaClO═Na2CO3+N2H4•H2O+NaCl