题目内容
用锌棒、铜棒和稀H2SO4溶液组成的原电池,铜棒为 极,电极上发生的是 反应(填“氧化”或“还原”),该电极反应式为 ,观察到的现象为 ;原电池反应的离子方程式为 .
考点:原电池和电解池的工作原理
专题:电化学专题
分析:锌比铜活泼,电解质溶液为稀硫酸,形成原电池时,锌为负极,发生氧化反应,铜为正极,氢离子在正极上发生还原反应生成氢气.
解答:
解:锌比铜活泼,电解质溶液为稀硫酸,形成原电池时,锌为负极,发生氧化反应,铜为正极,氢离子在正极上发生还原反应生成氢气,电极反应式为:2e-+2H+=H2↑,总反应的离子方程式为:Zn+2H+=Zn2++H2↑,
故答案为:正极;还原;2e-+2H+=H2↑;有气泡冒出;Zn+2H+=Zn2++H2↑.
故答案为:正极;还原;2e-+2H+=H2↑;有气泡冒出;Zn+2H+=Zn2++H2↑.
点评:本题考查原电池知识,侧重于学生的分析能力和基本理论的综合理解和运用的考查,为高频考点,注意把握原电池的工作原理以及电极方程式的书写,难度不大.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
下列各组物质按括号里的类别进行分类都正确的是( )
| A、空气(混合物)、C2H5OH(有机物)、H2SO4(化合物)、CO2(电解质) |
| B、液氨(非电解质)、NH4Cl(盐)、HNO3(含氧酸)、NaOH(强电解质) |
| C、HCl(化合物)、NaHCO3(酸)、Na2O2(碱性氧化物)、CCl4(电解质) |
| D、SO2(酸性氧化物)、CuSO4?5H2O(混合物)、CaO(碱性氧化物)BaCO3(电解质) |
已知25℃时溶解度:AgCl>AgI,若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
| A、c (K+)>c (NO3-)>c (Ag+)=c (Cl-)+c (I-) |
| B、c (K+)>c (NO3-)>c (Ag+)>c (Cl-)>c (I-) |
| C、c (NO3-)>c (K+)>c (Ag+)>c (Cl-)>c (I-) |
| D、c (K+)>c (NO3-)>c (Cl-)>c (Ag+)>c (I-) |
常温下,有关下列四种溶液的叙述正确的是(忽略混合后溶液的体积变化)( )
| ① | ② | ③ | ④ | |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | NaOH | CH3COOH | HCl |
| A、在①、②中分别加入氯化铵固体,两溶液的 pH均增大 |
| B、分别将等体积的①和②加水稀释m倍和n倍后,pH仍相同,则:m>n |
| C、把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D、将溶液②和溶液③等体积混合,混合后所得溶液的pH=7 |
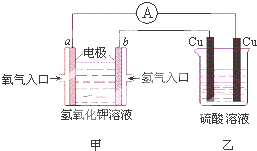 根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是( )
根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是( )| A、利用该反应可持续产生硫酸铜直至硫酸耗尽 | ||||
| B、甲中a电极的电极反应为:O2+4H++4e-=2H2O | ||||
C、装置开始工作初期乙中的总反应为:Cu+H2SO4
| ||||
| D、反应过程中甲、乙装置中溶液的pH都逐渐减小 |
下列说法正确的是( )
| A、pH=6的溶液一定呈酸性 |
| B、25℃时,pH=7的一定是纯水 |
| C、溶于水呈中性的盐一定未发生水解 |
| D、酸碱恰好中和时,溶液不一定为中性 |
设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A、常温常压下,16g14CH4所含中子数目为8NA |
| B、1 mol-CH3含有9 NA个电子 |
| C、常温常压下,44 g CO2气体含有氧原子的个数为2 NA |
| D、46gNO2和N2O4的混合物含有的原子数为3NA |
与50mL 0.1mol-1 Na2CO3 溶液中 Na+ 的物质的量浓度相同的溶液是( )
| A、50mL 0.2mol?L-1 的 NaCl 溶液 |
| B、100mL 0.1mol?L-1 的 NaCl 溶液 |
| C、25mL 0.2mol?L-1 的 Na2SO4 溶液 |
| D、10mL 0.5mol?L-1 的 Na2CO3 溶液 |
 如图所示,当关闭K时,向A(恒容)中充入1mol X、1mol Y,向B(带有活塞)中充入2mol X、2mol Y,起始时,V(A)=V(B)=aL.在相同温度和催化剂存在的条件下,两容器中各自发生下列反应:2X(g)+2Y(g)?Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时,V(B)=0.8aL.请回答:
如图所示,当关闭K时,向A(恒容)中充入1mol X、1mol Y,向B(带有活塞)中充入2mol X、2mol Y,起始时,V(A)=V(B)=aL.在相同温度和催化剂存在的条件下,两容器中各自发生下列反应:2X(g)+2Y(g)?Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时,V(B)=0.8aL.请回答: