题目内容
8.金属钠在实验室通常保存在煤油中,切下一小块钠进行化学实验,要用到的实验用品有镊子、小刀、玻璃片(或培养皿)、滤纸(或吸水纸),金属钠失火时,应该用干沙土灭火.过氧化钠与水反应,Na2O2(填化学式)作还原剂,反应后的溶液中加入酚酞的现象是先变红后退色.分析 钠是一种活泼金属,极易和水及氧气反应,所以应保存在煤油中.取用钠时,应该用镊子镊取,并且用滤纸吸干表面等煤油,再玻璃片上用小刀切割.钠燃烧生成过氧化钠,过氧化钠能和水、CO2反应产生氧气,所以应该用沙土扑灭.过氧化钠和水时,既作还原剂,又作氧化剂,过氧化钠具有氧化性,溶于水又显碱性,所以现象是先变红后退色.
解答 解:钠极易和水及氧气反应,所以应保存在煤油中;
取用钠时,应该用镊子镊取,并且用滤纸吸干表面等煤油,再玻璃片上用小刀切割,所以切下一小块钠进行化学实验,要用到的实验用品有:镊子、小刀、玻璃片(或培养皿)、滤纸(或吸水纸);
钠燃烧生成过氧化钠,过氧化钠能和水、CO2反应产生氧气,所以应该用干沙土扑灭;
过氧化钠和水时,既作还原剂,又作氧化剂,过氧化钠具有氧化性,溶于水又显碱性,所以现象是先变红后退色.
故答案为:煤油;镊子、小刀、玻璃片(或培养皿)、滤纸(或吸水纸);干沙土,Na2O2,先变红后退色.
点评 本题考查了钠及其化合物的性质,理解反应实质和反应产物的性质,把握基础知识的准确性,题目较简单.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
18.下列分子中有2个手性碳原子的是( )
| A. | 乳酸:CH3-CHOH-COOH | |
| B. | 甘油:CH2OH-CHOH-CH2OH | |
| C. | 脱氧核糖:CH2OH-CHOH-CHOH-CH2-CHO | |
| D. | 核糖:CH2OH-CHOH-CHOH-CHOH-CHO |

 .
.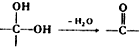
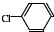 中氯原子较难水解物质A(
中氯原子较难水解物质A( 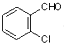 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式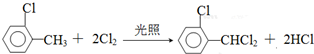 、
、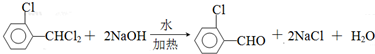 .该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式
.该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式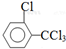 、
、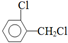 .
.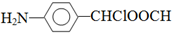 .
.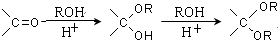
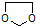 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: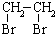
 ;
; ;C的化学名称为2,3-二甲基-1,3-丁二烯.
;C的化学名称为2,3-二甲基-1,3-丁二烯.
 对叔丁基苯酚
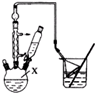
对叔丁基苯酚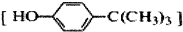 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下: .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.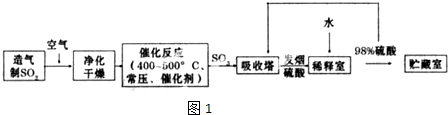
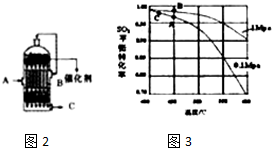
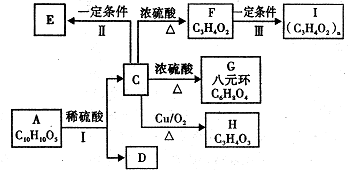
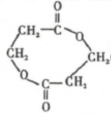 ,反应Ⅲ的化学方程式为
,反应Ⅲ的化学方程式为 .
.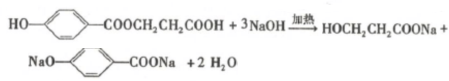 .
.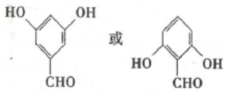 .
.