题目内容
19.化学与科学、社会、环境、生活等都密切相关,下列有关说法错误的是( )| A. | 食品包装中的干燥剂必须用特别包装纸包装,其成分多为氧化钙颗粒,也有硅胶颗粒 | |
| B. | 蛋白质、塑料、合成橡胶、光导纤维都是高分子化合物 | |
| C. | Fe2O3、CuO、PbO等金属氧化物是我国古代就已经使用的用于烧碱釉陶的彩色釉面原料 | |
| D. | 控制汽车尾气、工业尾气、建筑扬尘、垃圾焚烧等的任意排放是治理雾霾天气重要环节 |
分析 A.氧化钙和硅胶能作干燥剂;
B.光导纤维的主要成分是二氧化硅晶体;
C.Fe2O3、CuO、PbO等金属氧化物具有颜色,可以用作彩色釉面原料;
D.减少固体颗粒排放是治理雾霾天气重要环节.
解答 解:A.氧化钙和硅胶都具有吸水性,是常见的干燥剂,所以能作食品干燥剂,故A错误;
B.光导纤维的主要成分是二氧化硅晶体,二氧化硅不是高分子化合物,故B错误;
C.Fe2O3、CuO、PbO等金属氧化物具有颜色,而且化学性质较稳定,可以用作彩色釉面原料,故C正确;
D.减少固体颗粒排放是治理雾霾天气重要环节,所以控制汽车尾气、工业尾气、建筑扬尘、垃圾焚烧等的任意排放可以减少雾霾的形成,故D正确.
故选B.
点评 本题考查了化学与生活有关知识,明确常见干燥剂、光导纤维的成分、雾霾的形成等知识是解本题关键,题目难度不大.

练习册系列答案
相关题目
10. 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
I.该同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.请你设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是NaOH溶液,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
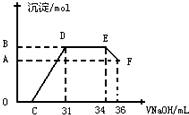
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应反应产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为:H++OH-═H2O.
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为:NH4++OH-═NH3•H2O.
(3)当图中C=13mL时,原溶液中Fe3+与Al3+的物质的量之比为2:1.
 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应反应产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为:H++OH-═H2O.
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为:NH4++OH-═NH3•H2O.
(3)当图中C=13mL时,原溶液中Fe3+与Al3+的物质的量之比为2:1.
7.下列分子中所有原子不可能共平面的是( )
| A. |  | B. | CF2═CF2 | C. | CH≡C-CH═CH2 | D. |  |
11.某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系).
请你帮助该同学整理并完成实验报告.
(1)实验目的:研究同周期元素性质的递变规律
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等.
仪器:①试管,②酒精灯,③烧杯,试管夹,镊子,小刀,玻璃片,砂纸,火柴等.
(3)实验内容:(填写与实验步骤对应的实验现象的编号和③、⑥的反应方程式)
实验步骤③涉及的化学方程式2Na+2H2O═2NaOH+H2↑,实验步骤 ⑥涉及的离子方程式Al3++4OH-=AlO2-+2H2O.
(4)实验结论:同一周期,随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强.
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭 |
(1)实验目的:研究同周期元素性质的递变规律
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等.
仪器:①试管,②酒精灯,③烧杯,试管夹,镊子,小刀,玻璃片,砂纸,火柴等.
(3)实验内容:(填写与实验步骤对应的实验现象的编号和③、⑥的反应方程式)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A-F) |
(4)实验结论:同一周期,随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强.
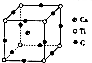
8.国际上至今发现具有巨磁电阻效应的20多种金属纳米多层膜中,其中三种是我国学者发现的,Mn和Bi形成的晶体薄膜是一种金属间化合物(晶胞结构如图),有关说法正确的是( )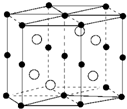

| A. | 锰价电子排布为3d74s0 | B. | Bi是d区金属 | ||
| C. | 该晶体的化学式为MnBi | D. | 该合金堆积方式是简单立方 |
9.氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②分析数据可知;人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③已知上述工业固氮反应的反应热△H=-92kJ/mol,1molN2、1molH2分子中的化学键断裂所吸收的能量分别为946kJ、436kJ,则N-H键断裂所吸收的能量为391kJ/mol.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较p1、p2的大小关系:р2>р1.

(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.8×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知;人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③已知上述工业固氮反应的反应热△H=-92kJ/mol,1molN2、1molH2分子中的化学键断裂所吸收的能量分别为946kJ、436kJ,则N-H键断裂所吸收的能量为391kJ/mol.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较p1、p2的大小关系:р2>р1.

 .
. .
. 短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p能级与所有s能级电子总数相等,D元素原子的L层能级中有3个未成对电子.
短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p能级与所有s能级电子总数相等,D元素原子的L层能级中有3个未成对电子.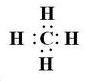 ,BC2属于非极性分子(填”极性“或”非极性“);当n=3时,B与C形成的晶体属于原子晶体.
,BC2属于非极性分子(填”极性“或”非极性“);当n=3时,B与C形成的晶体属于原子晶体.