题目内容
经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)其可能的情形是( )
| A、该溶液由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合而成 |
| B、该溶液由0.2 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合 |
| C、在上述溶液中加入适量CH3COOH,可能使溶液中离子浓度大小改变为:c(Na+ )>c(CH3COO-)>c(H+)>c(OH-) |
| D、该溶液由0.1 mol/L的CH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成 |
考点:离子浓度大小的比较
专题:
分析:某溶液中只有Na+、CH3COO-、H+、OH-四种离子,且其浓度大小的排列顺序为:c (Na+)>c(CH3COO-)>c(OH-)>c(H+),溶液呈碱性,溶液中的溶质可能是醋酸钠或醋酸钠和氢氧化钠的混合物,如果是醋酸钠和氢氧化钠的混合物,c(CH3COONa)>c(NaOH).
A.醋酸为弱酸,混合液中醋酸过量,溶液显示酸性,c(H+)>c(OH-);
B.由0.2 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合,溶质为等浓度的醋酸和醋酸钠,醋酸的电离程度大于醋酸根离子的水解程度,则c(Na+)<c(CH3COO-);
C.“c(Na+ )>c(CH3COO-)>c(H+)>c(OH-)”违反了电荷守恒;
D.醋酸与氢氧化钠等物质的量,反应生成醋酸钠,醋酸根离子部分水解,溶液显示碱性.
A.醋酸为弱酸,混合液中醋酸过量,溶液显示酸性,c(H+)>c(OH-);
B.由0.2 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合,溶质为等浓度的醋酸和醋酸钠,醋酸的电离程度大于醋酸根离子的水解程度,则c(Na+)<c(CH3COO-);
C.“c(Na+ )>c(CH3COO-)>c(H+)>c(OH-)”违反了电荷守恒;
D.醋酸与氢氧化钠等物质的量,反应生成醋酸钠,醋酸根离子部分水解,溶液显示碱性.
解答:
解:A.pH=3的CH3COOH溶液中c(CH3COOH)>0.001mol/L,pH=11的NaOH溶液中c(NaOH)=0.001mol/L,二者等体积混合时醋酸过量,溶液呈酸性,与题意不符合,故A错误;
B.由0.2 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合,反应后的溶液为等浓度的醋酸和醋酸钠,醋酸的电离程度大于醋酸根的水解程度,则c(Na+)<c(CH3COO-),溶液中 离子浓度为:c(CH3COO-)>c(Na+ )>c(H+)>c(OH-),故B错误;
C.根据电荷守恒得:c(H+)+c(Na+)=c(OH-)+c(CH3COO-),该关系“c(Na+ )>c(CH3COO-)>c(H+)>c(OH-)”违反了电荷守恒,故C错误;
D.0.1 mol/L的CH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成,溶质为醋酸钠,醋酸根离子水解,溶液显示碱性,则c(Na+)>c(CH3COO-)、c(OH-)>c(H+),溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D正确;
故选D.
B.由0.2 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合,反应后的溶液为等浓度的醋酸和醋酸钠,醋酸的电离程度大于醋酸根的水解程度,则c(Na+)<c(CH3COO-),溶液中 离子浓度为:c(CH3COO-)>c(Na+ )>c(H+)>c(OH-),故B错误;
C.根据电荷守恒得:c(H+)+c(Na+)=c(OH-)+c(CH3COO-),该关系“c(Na+ )>c(CH3COO-)>c(H+)>c(OH-)”违反了电荷守恒,故C错误;
D.0.1 mol/L的CH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成,溶质为醋酸钠,醋酸根离子水解,溶液显示碱性,则c(Na+)>c(CH3COO-)、c(OH-)>c(H+),溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D正确;
故选D.
点评:本题考查了溶液中离子浓度大小比较、酸碱混合的定性判断方法,题目难度中等,注意掌握酸碱混合的定性判断方法,明确判断溶液中离子浓度大小常用方法,如:电荷守恒、物料守恒、盐的水解原理等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知X、Y两元素能实现如图所示的转化: ,下列说法中错误的是( )
,下列说法中错误的是( )
 ,下列说法中错误的是( )
,下列说法中错误的是( )| A、X可以是金属 |
| B、X可以是非金属 |
| C、m可以等于1或2 |
| D、XYm与XYn的相互转化是可逆反应 |
下列反应的离子方程式书写中,正确的是( )
| A、将氨水逐滴滴加到AlCl3溶液中:Al3++3OH-=Al(OH)3↓ |
| B、铜与稀硝酸反应:Cu+4H++NO3-=Cu2++NO↑+2H2O |
| C、硫酸与氢氧化钡在溶液中反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、用FeCl3溶液腐蚀铜箔制造的印刷电路板:2Fe3++Cu=2Fe2++Cu2+ |
下表中除杂方法正确的是( )
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A. | CO | CO2 | 通过足量氢氧化钠溶液,并干燥 |
| B. | H2 | 水蒸气 | 通过盛有浓硫酸的洗气瓶 |
| C. | N2 | O2 | 通过炽热的木炭 |
| D. | NaOH溶液 | Na2CO3 | 加入足量稀盐酸至不再产生气泡 |
| A、A | B、B | C、C | D、D |
下列分离或提纯物质的方法正确的是( )
| A、用过滤的方法分离在一定量苯酚溶液中加入足量浓溴水后的混合物 |
| B、用加热的方法提纯含有少量碳酸钠的碳酸氢钠固体 |
| C、用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡 |
| D、用盐析的方法分离、提纯蛋白质 |
 如图里有6个编号,每个编号代表下列物质中的一种物质,凡用直线连接的相邻两种物质均能发生化学反应,供填写的物质有:a.碳酸钠溶液;b.硫酸镁溶液;C.氯化钡溶液;d.稀硫酸;e.铁;f.硝酸铜溶液,则图中③表示的物质的编号是( )
如图里有6个编号,每个编号代表下列物质中的一种物质,凡用直线连接的相邻两种物质均能发生化学反应,供填写的物质有:a.碳酸钠溶液;b.硫酸镁溶液;C.氯化钡溶液;d.稀硫酸;e.铁;f.硝酸铜溶液,则图中③表示的物质的编号是( )| A、e | B、f | C、a | D、d |
已知卤代烃在碱性条件下易水解.某有机物的结构简式如下则下列说法正确的是( )

| A、该有机物的分子式为:C16H9O8N2Br2 |
| B、向该有机物溶液中加入FeCl3溶液,振荡后有紫色沉淀产生 |
| C、1mol该有机物与足量的NaOH溶液混合共热,充分反应最多可消耗6 mol NaOH |
| D、该有机物在稀硫酸中加热水解,有机产物只有一种 |
 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某不同品牌铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某不同品牌铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.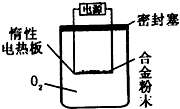
 某学习小组设计用如下装置验证二氧化硫的化学性质.
某学习小组设计用如下装置验证二氧化硫的化学性质.