题目内容
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.下面某研究小组开展的研究:
(1)用CO2来生产燃料甲醇.实验在体积为1L的密闭容器中进行,充入1mol CO2和3mol H2,在一定条件下发生反应策得反应混合物中有甲醇气体和水(气体)产生,查得在该类反应中,每生成16g甲醇,放出的热量为24.5kJ.
①该反应的热化学方程式为: ;
②实验中,测得CO2和CH3OH(g)的浓度随时间变化如图所示.从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L?min).

从曲线变化可以得出:CO2和CH3OH(g)的浓度经过一段时间,不再变化,原因是 .
③理论上44g CO2和6g H2完全反应,产生的热量为Q= KJ,如果将44g CO2和6g H2置于密闭容器中反应,实际放出的热量 Q(选填“大于”或“小于”或”“等于”)原因是 .
④为提高反应混合物中n(CH3OH)/n(CO2)的值,研究小组采取了系列措施进行实验,其中有效果的是 .
A.升高温度 B.充入He(g),使体系压强增大C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(2).针对载人航天器的生态系统要求:分离去除CO2,并提供充足的O2.发明了一种电化学装置可实现转化:2CO2=2CO+O2,产生的CO又可用作燃料.已知该装置的阳极反应为:4OH--4e-=O2↑+2H2O则阴极反应式为: .
(1)用CO2来生产燃料甲醇.实验在体积为1L的密闭容器中进行,充入1mol CO2和3mol H2,在一定条件下发生反应策得反应混合物中有甲醇气体和水(气体)产生,查得在该类反应中,每生成16g甲醇,放出的热量为24.5kJ.
①该反应的热化学方程式为:
②实验中,测得CO2和CH3OH(g)的浓度随时间变化如图所示.从反应开始到平衡,氢气的平均反应速率v(H2)=

从曲线变化可以得出:CO2和CH3OH(g)的浓度经过一段时间,不再变化,原因是
③理论上44g CO2和6g H2完全反应,产生的热量为Q=
④为提高反应混合物中n(CH3OH)/n(CO2)的值,研究小组采取了系列措施进行实验,其中有效果的是
A.升高温度 B.充入He(g),使体系压强增大C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(2).针对载人航天器的生态系统要求:分离去除CO2,并提供充足的O2.发明了一种电化学装置可实现转化:2CO2=2CO+O2,产生的CO又可用作燃料.已知该装置的阳极反应为:4OH--4e-=O2↑+2H2O则阴极反应式为:
考点:化学平衡的计算,热化学方程式,原电池和电解池的工作原理,化学平衡的影响因素,物质的量或浓度随时间的变化曲线
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)①反应生成 CH3OH和H2O,n(CH3OH)=0.5mol,方程式为CO2(g)+3H2(g)?CH3OH(g)+H2O(g),根据方程式计算反应热;
②由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式可知氢气的浓度变化等于甲醇的浓度变化量3倍为2.25mol/L,根据v=
计算v(H2),CO2和CH3OH(g)的浓度经过一段时间,不再变化,说明达到平衡状态;
③反应为可逆反应,不能反应完全;
④使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量;
(2)阴极发生还原反应,CO2被还原生成CO.
②由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式可知氢气的浓度变化等于甲醇的浓度变化量3倍为2.25mol/L,根据v=
| △c |
| △t |
③反应为可逆反应,不能反应完全;
④使n(CH3OH)/n(CO2)应采取措施,使平衡向正反应移动,注意不能增大二氧化碳或降低甲醇的量;
(2)阴极发生还原反应,CO2被还原生成CO.
解答:
解:(1)①反应生成 CH3OH和H2O,n(CH3OH)=0.5mol,方程式为CO2(g)+3H2(g)?CH3OH(g)+H2O(g),则生成1molCH3OH放出49.0kJ的能量,反应的热化学方程式为CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,
故答案为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol;
②由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=
=0.225mol/(L?mon),
从曲线变化可以得出:CO2和CH3OH(g)的浓度经过一段时间,不再变化,原因是反应达到平衡状态,正逆反应速率相等,浓度不再改变,
故答案为:0.225;反应处于化学平衡态(或正反应速度与逆反应速度相等);
③理论上44g CO2和6g H2完全反应,即1molCO2和3molH2完全反应,产生的热量为Q=49.0KJ,但由于反应为可逆反应,则实际放出的热量小于Q,
故答案为:49.0;小于;反应是可逆反应,不能进行到底;
④A.该反应正反应是放热反应,升高温度平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误,
B.充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误,
C.将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确,
D.再充入1mol CO2和3mol H2,等效为增大压强,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故D正确;
故答案为:C、D;
(2)阳极反应为:4OH--4e-=O2↑+2H2O,已知总反应为2CO2=2CO+O2,由总反应减阳极反应式可得阴极反应式为2CO2+4e-+2H2O=2CO+4OH-,
故答案为:2CO2+4e-+2H2O=2CO+4OH-.
故答案为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol;
②由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,由方程式CO2(g)+3H2(g)?CH3OH(g)+H2O可知,氢气的浓度变化等于甲醇的浓度变化量为0.75mol/L×3=2.25mol/L,故v(H2)=
| 2.25mol/L |
| 10min |
从曲线变化可以得出:CO2和CH3OH(g)的浓度经过一段时间,不再变化,原因是反应达到平衡状态,正逆反应速率相等,浓度不再改变,
故答案为:0.225;反应处于化学平衡态(或正反应速度与逆反应速度相等);
③理论上44g CO2和6g H2完全反应,即1molCO2和3molH2完全反应,产生的热量为Q=49.0KJ,但由于反应为可逆反应,则实际放出的热量小于Q,
故答案为:49.0;小于;反应是可逆反应,不能进行到底;
④A.该反应正反应是放热反应,升高温度平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误,
B.充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误,
C.将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确,
D.再充入1mol CO2和3mol H2,等效为增大压强,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故D正确;
故答案为:C、D;
(2)阳极反应为:4OH--4e-=O2↑+2H2O,已知总反应为2CO2=2CO+O2,由总反应减阳极反应式可得阴极反应式为2CO2+4e-+2H2O=2CO+4OH-,
故答案为:2CO2+4e-+2H2O=2CO+4OH-.
点评:本题考查较为综合,涉及反应速率、平衡计算、平衡移动以及电化学等知识,综合考查学生的分析能力和计算能力,为高考常见题型,题目难度中等,注意把握影响平衡移动的因素以及平衡移动方向的判断.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
 右图是某中学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
右图是某中学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )| A、该硫酸试剂的物质的量浓度为18.4 mol?L-1 |
| B、该硫酸与等体积的水混合所得溶液的质量分数小于49% |
| C、50mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46mol |
| D、常温下2.7 gAl与足量的该硫酸反应可得到标准状况下的H2 3.36 L |
下列反应中,不属于氧化还原反应的是( )
| A、Zn+2HCl=ZnCl2+H2↑ | ||||
| B、Na2CO3+CaCl2=CaCO3↓+2NaCl | ||||
C、2H2O
| ||||
| D、H2+Cl2=2HCl |
 设nA为阿伏加德罗常数的值,下列叙述正确的是( )
设nA为阿伏加德罗常数的值,下列叙述正确的是( )| A、常温常压下,16g14CH4所含中子数目为8nA |
| B、标准状况下,22.4 LCCl4所含分子数目为nA |
| C、1 L 0.5 mol?L-1的CH3COONa溶液中所含的CH3COO-离子数目为0.5nA |
| D、6.2g白磷(分子式为P4,分子结构如图所示)所含P-键数目为0.3nA |
下列装置和操作能达到实验目的是( )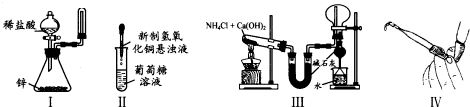

| A、实验I:制取并收集氢气 |
| B、实验II:验证葡萄糖的还原性 |
| C、实验III:实验室制氨气并收集干燥的氨气 |
| D、实验Ⅳ:检查碱式滴定管是否漏液 |
设阿伏加德罗常数的数值为nA,下列说法正确的是( )
| A、1molNa2O2和水完全反应,转移电子数为2nA |
| B、0.5L0.2mol?L-1FeCl3溶液中,含Fe3+离子数为0.1nA |
| C、理论上氢氧燃料电池负极消耗11.2L标准状况下气体,外线路通过电子数为nA |
| D、常温常压下,28g乙烯和丙烯混合气体含有的碳原子总数为2.5nA |
设NA为阿伏加德罗常数,下列叙述正确的是(相对原子质量:O 16)( )
| A、1moL铁与足量氯气完全反应转移的电子数目为2NA |
| B、32g氧气和32g臭氧(O3)所含有的氧原子数均为2NA |
| C、100mLlmol/LFeCl3溶液中含有Fe3+为0.1NA |
| D、用含4molHCl的浓盐酸与足量MnO2加热反应,产生Cl2的分子数为NA |
 CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.