题目内容
在含有Cu(NO3)2、Zn(NO3)2、AgNO3各0.1mol的混合溶液中加入0.1molFe粉,充分搅拌后铁溶解,溶液中不在Fe3+离子,同时析出0.1molAg.则下列结论中不正确的是( )
| A、氧化性:Ag+>Cu2+>Zn2+ |
| B、溶液中Cu2+与Fe2+的物质的量之比为1:1 |
| C、Ag+的最先与Fe反应 |
| D、1molFe可还原1molCu2+ |
考点:有关混合物反应的计算
专题:
分析:A.金属性越强,相应离子的氧化性越弱;
B.Fe先还原Ag+,然后还原Cu2+,Fe均生成Fe2+,根据电子转移守恒计算被还原的Cu2+的物质的量,进而计算溶液中Cu2+的物质的量,根据Fe元素守恒计算Fe2+的物质的量;
C.Ag+的氧化性最强,最先与Fe反应;
D.发生反应:Cu2++Fe═Fe2++Cu,根据方程式计算.
B.Fe先还原Ag+,然后还原Cu2+,Fe均生成Fe2+,根据电子转移守恒计算被还原的Cu2+的物质的量,进而计算溶液中Cu2+的物质的量,根据Fe元素守恒计算Fe2+的物质的量;
C.Ag+的氧化性最强,最先与Fe反应;
D.发生反应:Cu2++Fe═Fe2++Cu,根据方程式计算.
解答:
解:A.金属性Zn>Cu>Ag,金属性越强,相应离子的氧化性越弱,故氧化性:Ag+>Cu2+>Zn2+,故A正确;
B.Fe先还原Ag+,然后还原Cu2+,Fe均生成Fe2+,根据电子转移守恒,析出0.1molAg需要Fe为
=0.05mol,剩余Fe为0.05mol,0.05mol完全反应可以还原Cu2+为0.05mol,故溶液中剩余Cu2+为0.1mol-0.05mol=0.05mol,根据Fe元素守恒溶液中Fe2+的物质的量为0.1mol,故溶液中Cu2+与Fe2+的物质的量之比为0.05mol:0.1mol=1:2,故B错误;
C.Ag+的氧化性最强,最先与Fe反应,故C正确;
D.发生反应:Cu2++Fe═Fe2++Cu,根据方程式可知1molFe可还原1molCu2+,故D正确,
故选B.
B.Fe先还原Ag+,然后还原Cu2+,Fe均生成Fe2+,根据电子转移守恒,析出0.1molAg需要Fe为
| 0.1mol×1 |
| 2 |
C.Ag+的氧化性最强,最先与Fe反应,故C正确;
D.发生反应:Cu2++Fe═Fe2++Cu,根据方程式可知1molFe可还原1molCu2+,故D正确,
故选B.
点评:本题考查氧化还原反应,侧重于考查学生的分析能力和计算能力,关键是理解掌握物质的氧化性的强弱,难度中等.

练习册系列答案
相关题目
在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
| A、Cu2+、K+、Cl-、NO3- |
| B、Ag+、Na+、Cl-、NO3- |
| C、Mg2+、Al3+、SO42-、Cl- |
| D、Ba2+、NH4+、Cl-、HCO3- |
区分胶体与溶液的依据是( )
| A、分散质直径大小 |
| B、是否有丁达尔现象 |
| C、是否稳定 |
| D、分散质粒子是否带电 |
针对如图所示乙醇分子结构,下述关于乙醇在各种化学反应中化学键断裂情况的说法不正确的是( )


| A、与醋酸、浓硫酸共热时,②键断裂 |
| B、与金属钠反应时,①键断裂 |
| C、与浓硫酸共热至170℃时,②、④键断裂 |
| D、在Ag催化下与O2反应时,①、③键断裂 |
关于分子或离子中心原子的杂化轨道类型和空间构型,下列判断正确的是( )
| A、PH3、sp2平面三角形 |
| B、SO32-、sp2 平面三角形 |
| C、NO3-、sp3 三角锥形 |
| D、SO2、sp2V形 |
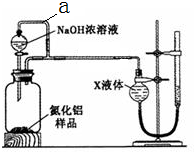 氮化铝(AlN)是一种新型无机材料.
氮化铝(AlN)是一种新型无机材料.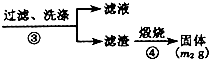
 A、B、C、D均为中学常见物质,其中A为单质,B、C、D为化台物,并且存在如下转化关系:试回答下列问题:
A、B、C、D均为中学常见物质,其中A为单质,B、C、D为化台物,并且存在如下转化关系:试回答下列问题: