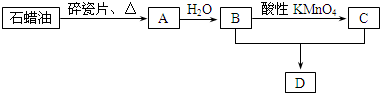
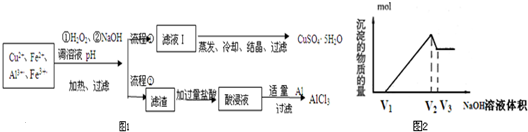
题目内容
某实验需要500mL、0.1mol/L的NaOH溶液,现通过如下操作配制:
①把称量好的 g固体NaOH放入小烧杯中,加适量蒸馏水溶解.为加快溶解可以使用 (填仪器名称)搅拌;②把①所得溶液冷却到室温后,小心转入 (填仪器名称和规格);③继续加蒸馏水至液面至刻度线1~2cm处,改用 (填仪器名称)小心滴加蒸馏水至溶液凹液面最低点与刻度线相切;④用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀.
(1)操作步骤正确的顺序是 (填序号).
(2)若没有操作④,则所配溶液的浓度会 (填“偏高”或“偏低”).
(3)若所配溶液的密度为1.06g/mL,则该溶液的质量分数为 .
(4)若取出20mL配好的NaOH溶液,加蒸馏水稀释成c(Na+)=0.01mol/L的溶液,则稀释后溶液的体积为 mL.
(5)在配制500mL、0.1mol/L的NaOH溶液时,下列操作中的 会导致结果偏低(请用序号填写).
①用滤纸称量NaOH
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③定容时俯视刻度线
④定容时仰视刻度线
⑤干净的容量瓶未经干燥就用于配制溶液.
①把称量好的
(1)操作步骤正确的顺序是
(2)若没有操作④,则所配溶液的浓度会
(3)若所配溶液的密度为1.06g/mL,则该溶液的质量分数为
(4)若取出20mL配好的NaOH溶液,加蒸馏水稀释成c(Na+)=0.01mol/L的溶液,则稀释后溶液的体积为
(5)在配制500mL、0.1mol/L的NaOH溶液时,下列操作中的
①用滤纸称量NaOH
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③定容时俯视刻度线
④定容时仰视刻度线
⑤干净的容量瓶未经干燥就用于配制溶液.
考点:配制一定物质的量浓度的溶液
专题:
分析:①根据n=cV和m=nM来计算需要的氢氧化钠的质量,搅拌所用的仪器是玻璃棒;
②容量瓶只有一条刻度线,只能用于配制其对应规格的体积的溶液,根据配制的是500mL、0.1mol/L的NaOH溶液,来选择合适的容量瓶;
③定容时用的仪器是胶头滴管;
(1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
(2)没有洗涤烧杯和玻璃棒,会导致溶质的损失,据此分析;
(3)根据C=
来计算;
(4)根据溶液稀释定律C浓V浓=C稀V稀来计算;
(5)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
②容量瓶只有一条刻度线,只能用于配制其对应规格的体积的溶液,根据配制的是500mL、0.1mol/L的NaOH溶液,来选择合适的容量瓶;
③定容时用的仪器是胶头滴管;
(1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
(2)没有洗涤烧杯和玻璃棒,会导致溶质的损失,据此分析;
(3)根据C=
| 1000ρω |
| M |
(4)根据溶液稀释定律C浓V浓=C稀V稀来计算;
(5)根据c=
| n |
| V |
解答:
解:①需要的氢氧化钠的物质的量n=cV=0.1mol/L×0.5L=0.05mol,质量m=nM=0.05mol×40g/mol=2.0g,搅拌所用的仪器是玻璃棒,故答案为:2.0;玻璃棒;
②容量瓶只有一条刻度线,只能用于配制其对应规格的体积的溶液,根据配制的是500mL0.1mol/L的NaOH溶液,故选择的容量瓶为500mL容量瓶,故答案为:500mL容量瓶;
③定容时先向容量瓶中注水至液面至刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低点与刻度线相切,故答案为:胶头滴管;
(1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是①②④③⑤,故答案为:①②④③⑤;
(2)没有洗涤烧杯和玻璃棒,会导致溶质的损失,则导致所配溶液的浓度偏低,故答案为:偏低;
(3)设溶液的质量分数为ω,根据所配溶液的物质的量浓度C=
=
=0.1mol/L,解得ω=0.0038即0.38%,故答案为:0.38%;
(4)在氢氧化钠溶液中,c(NaOH)=c(Na+)=0.01mol/L,设稀释后溶液的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:
20mL×0.1mol/L=0.01mol/L×VmL,解得V=200mL,故答案为:200;
(5)①由于氢氧化钠易潮解,用滤纸称量NaOH会导致氢氧化钠潮解且很难将滤纸上的氢氧化钠全部倒入烧杯,引起氢氧化钠的损失,导致浓度偏低,故①选;
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,会导致溶质的损失,浓度偏低,故②选;
③定容时俯视刻度线,则导致溶液的体积偏小,浓度偏高,故③不选;
④定容时仰视刻度线,则导致溶液体积偏大,浓度偏低,故④选;
⑤若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故⑤不选;
故选①②④.
②容量瓶只有一条刻度线,只能用于配制其对应规格的体积的溶液,根据配制的是500mL0.1mol/L的NaOH溶液,故选择的容量瓶为500mL容量瓶,故答案为:500mL容量瓶;
③定容时先向容量瓶中注水至液面至刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低点与刻度线相切,故答案为:胶头滴管;
(1)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是①②④③⑤,故答案为:①②④③⑤;
(2)没有洗涤烧杯和玻璃棒,会导致溶质的损失,则导致所配溶液的浓度偏低,故答案为:偏低;
(3)设溶液的质量分数为ω,根据所配溶液的物质的量浓度C=
| 1000ρω |
| M |
| 1000×1.06g/ml×ω |
| 40g/mol |
(4)在氢氧化钠溶液中,c(NaOH)=c(Na+)=0.01mol/L,设稀释后溶液的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:
20mL×0.1mol/L=0.01mol/L×VmL,解得V=200mL,故答案为:200;
(5)①由于氢氧化钠易潮解,用滤纸称量NaOH会导致氢氧化钠潮解且很难将滤纸上的氢氧化钠全部倒入烧杯,引起氢氧化钠的损失,导致浓度偏低,故①选;
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,会导致溶质的损失,浓度偏低,故②选;
③定容时俯视刻度线,则导致溶液的体积偏小,浓度偏高,故③不选;
④定容时仰视刻度线,则导致溶液体积偏大,浓度偏低,故④选;
⑤若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故⑤不选;
故选①②④.
点评:本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
某同学欲配制下列含有四种不同阴、阳离子的溶液,其中能配制成功的是( )
| A、Ca2+、H+、Cl-、HCO3- |
| B、Mg2+、Al3+、Cl-、SO42- |
| C、Na+、H+、NO3-、OH- |
| D、NH4+、Ag+、HCO3-、OH- |
下列除去杂质的试剂正确的是( )
①除去CH4中少量C2H4:酸性KMnO4溶液
②除去乙酸乙酯中的少量乙酸:饱和Na2CO3溶液
③除去CO2中少量SO2:饱和Na2CO3溶液
④除去C2H2中少量H2S:CuSO4溶液
⑤除去溴苯中混有的少量溴:NaOH溶液.
①除去CH4中少量C2H4:酸性KMnO4溶液
②除去乙酸乙酯中的少量乙酸:饱和Na2CO3溶液
③除去CO2中少量SO2:饱和Na2CO3溶液
④除去C2H2中少量H2S:CuSO4溶液
⑤除去溴苯中混有的少量溴:NaOH溶液.
| A、②③④⑤ | B、②④⑤ |
| C、①②④⑤ | D、③④⑤ |
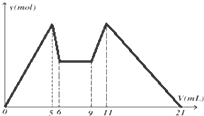 如图是向MgCl2、AlCl3混合溶液中,先后加入试剂A、B时所得沉淀物质的量y(mol) 与试剂体积V(mL)间的关系图.开始滴加6mL试剂A后继续滴加A若干,之后改滴试剂B.以下结论正确的是( )
如图是向MgCl2、AlCl3混合溶液中,先后加入试剂A、B时所得沉淀物质的量y(mol) 与试剂体积V(mL)间的关系图.开始滴加6mL试剂A后继续滴加A若干,之后改滴试剂B.以下结论正确的是( )| A、可能是NaOH,B可能是盐酸,且2C(A)=C(B) |
| B、若A和B均为一元强酸或一元强碱,则滴加7mL试剂A后改滴试剂B |
| C、A可能是Ba(OH)2,B可能是硫酸,且C(A)=C(B) |
| D、原混合液中,c(Al3+):c(Mg2+):c(Cl-)=1:2:7 |
下列溶液中各微粒的浓度关系不正确的是( )
| A、0.1mol?L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) |
| B、0.1mol?L-1 NH4Cl溶液中:c(NH4+)+c(NH3?H2O)=c(Cl-) |
| C、0.1mol?L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、等体积、等物质的量浓度的CH3COONa和弱酸CH3COOH混合后的溶液中:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-) |
下列各组离子在溶液中能大量共存的是( )
| A、Fe3+、SCN-、Na+、Cl- |
| B、Cl-、AlO2-、HCO3-、Na+ |
| C、Fe2+、NH4+、SO42-、S2- |
| D、Ca2+、HCO3-、Cl-、K+ |