题目内容
下列实验设计方法正确的是( )

A.向卤代烃加硝酸酸化的硝酸银来检验其中的卤族素元素
B.实验用NH4Cl固体受热分解来制备NH3
C.用盐酸和澄清石灰水来检验某物质是否含有CO32-
D.可用下图所示的装置和药品来研究反应物浓度对反应速率的影响
练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
(10分)在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
阳离子 | K+、Ag+、Mg2+、Ba2+ |
阴离子 | NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 在Ⅱ的滤液中滴加BaC12溶液 | 无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
阴离子 | NO3- | CO32- | SiO32- | SO42- |
c/mol·L-1 |
|
|
|
|
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由 。

 2C(g),以下表示其化学反应速率最快的是
2C(g),以下表示其化学反应速率最快的是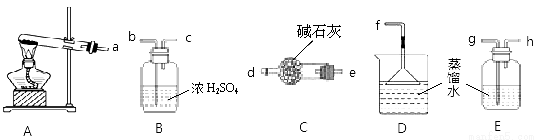
 2NH3(g) △H= -92.4kJ·mol-1
2NH3(g) △H= -92.4kJ·mol-1 2NH3,5min后达到平衡,平衡时氨的体积分数为25%。
2NH3,5min后达到平衡,平衡时氨的体积分数为25%。 (N2)= _________________;
(N2)= _________________; 2NO2(g) △H>0。该反应的反应速率(
2NO2(g) △H>0。该反应的反应速率( )变化的关系如图所示。若
)变化的关系如图所示。若 时刻只改变一个条件,下列说法正确的是(填选项序号) 。
时刻只改变一个条件,下列说法正确的是(填选项序号) 。
 时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
时,可依据容器内气体的压强保持不变判断反应已达到平衡状态 时,采取的措施可以是升高温度
时,采取的措施可以是升高温度 时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
时,可依据容器内气体的密度保持不变判断反应已达到平衡状态 时,容器内
时,容器内 的体积分数是整个过程中的最大值
的体积分数是整个过程中的最大值
 键的数目为 。
键的数目为 。