题目内容
有一块铁的“氧化物”样品,用140mL 5.0mol·L-1 盐酸恰好将之完全溶解,所得溶液还能吸收0.025mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为( )
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
D
【解析】
试题解析:n (HCl)=0.14L×5.0mol/L=0.7mol,由氧化物和盐酸反应生成水可知,氧化物中含有n(O)= n(HCl)=0.35mol,
n(HCl)=0.35mol,
所得溶液还能吸收0.025mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,反应后所得溶液为FeCl3,因n(Cl-)=0.7mol+0.025mol×2=0.75mol,则n(Fe3+)=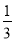 n(Cl-)=0.25mol,所以氧化物中n(Fe):n(O)=0.25:0.35=5:7,
n(Cl-)=0.25mol,所以氧化物中n(Fe):n(O)=0.25:0.35=5:7,
所以化学式为Fe5O7,选D.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
下列实验中,所采取的分离方法与对应原理都正确的是 ( )
选项 | 目的 | 分离方法 | 原理 |
A. | 分离氢氧化铁胶体和氯离子 | 盐析 | 胶体不能透过半透膜,离子能 |
B. | 分离植物油和水的混合物 | 分液 | 二者互不相溶且密度不同 |
C. | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
D. | 除去乙醇中的乙酸 | 蒸馏 | 乙醇与乙酸沸点相差较大 |
 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑