题目内容
已知l g CH4完全燃烧生成CO2和液态水时放出55.6kJ的热量,则下列甲烷燃烧的热化学方程式正确的是( )
| A、CH4+2O2=CO2+2H2O△H═-889.6kJ/mol |
| B、CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+889.6kJ/mol |
| C、CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-55.6kJ/mol |
| D、CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6kJ/mol |
考点:热化学方程式
专题:化学反应中的能量变化
分析:A.未注明物质的聚集状态;
B.甲烷燃烧为放热反应,△H<0;
C.热化学方程式中的化学计量数只表示反应物或生成物的物质的量;
D.根据lgCH4燃烧放出的热量分析解答.
B.甲烷燃烧为放热反应,△H<0;
C.热化学方程式中的化学计量数只表示反应物或生成物的物质的量;
D.根据lgCH4燃烧放出的热量分析解答.
解答:
解:A.化学反应中的能量变化与物质的聚集状态有关,热化学方程式必须注明物质的聚集状态,故A错误;
B.已知l g CH4完全燃烧生成CO2和液态水时放出55.6kJ的热量,说明甲烷燃烧为放热反应,△H<0,故B错误;
C.lgCH4的物质的量为n=
=
=
mol,完全燃烧生成CO2和液态水时放出55.6kJ的热量,则1mol甲烷反应燃烧反应放热55.6KJ×16=889.6KJ,热化学方程式中的化学计量数只表示反应物或生成物的物质的量,所以反应为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6KJ/mol,故C错误;
D.根据C分析,lgCH4的物质的量为n=
=
=
mol,完全燃烧生成CO2和液态水时放出55.6kJ的热量,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6KJ/mol,故D正确;
故选D.
B.已知l g CH4完全燃烧生成CO2和液态水时放出55.6kJ的热量,说明甲烷燃烧为放热反应,△H<0,故B错误;
C.lgCH4的物质的量为n=
| m |
| M |
| 1g |
| 16g/mol |
| 1 |
| 16 |
D.根据C分析,lgCH4的物质的量为n=
| m |
| M |
| 1g |
| 16g/mol |
| 1 |
| 16 |
故选D.
点评:本题主要考查了热化学方程式,掌握△H的含义以及与化学计量数间的关系是解答的关键,注意热化学方程式概念的运用,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
用如图所示装置进行实验,装置正确且设计合理的是( )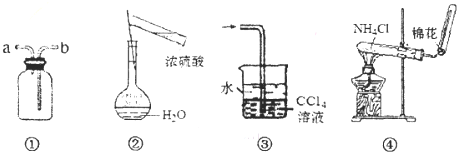

| A、装置①可用于排空气法收集NO气体 |
| B、可用图②所示装置及操作配制一定物质的量浓度的硫酸 |
| C、装置③可用于吸收氯化氢或氨气 |
| D、实验室可用装置④制取NH3 |
在配制Fe2(SO4)3溶液时,为了抵制水解,常常往溶液中加入少量的:( )
| A、H2SO4 |
| B、NaOH |
| C、KCl |
| D、CH3COOH |
某原电池的总反应离子方程为Fe+Cu2+=Fe2++Cu不能实现该反应的原电池是( )
| A、正极为Cu,负极为Fe,电解质溶液为FeCl3溶液 |
| B、正极为C,负极为Fe,电解质溶液为CuSO4溶液 |
| C、正极为Pt,负极为Fe,电解质溶液为CuSO4溶液 |
| D、正极为Ag,负极为Fe,电解质溶液为CuSO4溶液 |
0.1mol/L氨水和0.1mol/L盐酸等体积混合后,溶液中离子浓度大小顺序正确的是( )
| A、c(Cl-)>c(H-)>c(NH4+)>c(OH-) |
| B、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、c(Cl-)>c(OH-)>c(NH4+)>c(H+) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
稀氨水中存在下述平衡:NH3+H20?NH3?H2O?NH4++OH-改变下列条件,能使电离程度增大的是( )
| A、加浓氨水 |
| B、升高温度 |
| C、加NH4Cl溶液 |
| D、加NaOH溶液 |
在一定条件下发生下列反应,其中属于盐类水解反应的是( )
| A、HS-+H+═H2S |
| B、HCO3-+H2O?H3O++CO32- |
| C、NH4++H2O?NH3?H2O+H+ |
| D、Cl2+H2O?H++Cl-+HClO |