题目内容
16.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属元素.下列说法正确的是( )| A. | 原子半径:A<B<C<D<E | |
| B. | 化合物AE与CE含有相同类型的化学键 | |
| C. | 简单气态氢化物的热稳定性:B>E | |
| D. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应 |
分析 元素B的原子最外层电子数是其电子层数的2倍,B为2个电子层时,B为C,为3个电子层时为S,A、E的单质在常温下呈气态,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料,则D为Al,结合原子序数依次增大,则E为Cl,C为Na,B只能为C,A为H,然后结合元素及其化合物的性质来解答.
解答 解:元素B的原子最外层电子数是其电子层数的2倍,B为2个电子层时,B为C,为3个电子层时为S,A、E的单质在常温下呈气态,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料,则D为Al,结合原子序数依次增大,则E为Cl,C为Na,B只能为C,A为H,
A.电子层越多,原子半径越大,电子层相同时,原子序数越大,半径越小,所以H<C<Cl<Al<Na,即A<B<E<D<C,故A错误;
B.化合物HCl中只含有共价键,NaCl中只含有离子键,所以含有不相同类型的化学键,故B错误;
C.元素的非金属性越强,其氢化物的稳定性越强,所以简单气态氢化物的热稳定性:E>B,故C错误;
D.一定条件下,元素Na、Al的最高价氧化物对应的水化物为NaOH、Al(OH)3,二者之间能发生反应生成偏铝酸钠和水,故D正确;
故选D.
点评 本题考查了位置、结构、性质的关系及应用,元素的推断是解答的关键,注意把握元素的性质及单质、化合物的性质即可解答,题目难度中等.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
5.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | pH=a的醋酸溶液,稀释10倍后,其pH=b,则a=b-1 | |
| B. | 含等物质的量的NaHSO3和Na2SO3的溶液:2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)] | |
| C. | 0.1mol•L-1盐酸与0.2mol•L-1氨水等体积混合:c(NH3•H2O)>c(Cl-)>c(NH4+)>c(OH-) | |
| D. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
7.某有机物结构简式如图,下列叙述不正确的是( )
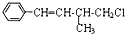
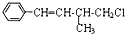
| A. | 该有机物的分子式为C11H13Cl | |
| B. | 该有机物能使溴水褪色 | |
| C. | 该有机物遇硝酸银溶液产生白色沉淀 | |
| D. | 该有机物在一定条件下,能发生消去反应或取代反应 |
4.下列实验的操作、现象、解释或结论都正确的是( )
| 选项 | 操作、现象 | 解释或结论 |
| A | 某溶液中先加稀HCl酸化,再加AgNO3,产生白色沉淀 | 原溶液有Cl-存在 |
| B | Cl2能使湿润的红布条褪色 | Cl2具有漂白性 |
| C | Na2SiO3溶液中通入CO2产生白色胶状沉淀 | H2CO3酸性大于H2SiO3 |
| D | 光照氯水有气泡产生 | 该气体一定是Cl2 |
| A. | A | B. | B | C. | C | D. | D |
11.2SO2+O2$?_{△}^{催化剂}$2SO3是工业制硫酸的一步重要反应,下列关于该反应的说法正确的是( )
| A. | 使用催化剂不影响反应速率 | B. | 升高体系温度能加快反应速率 | ||
| C. | 减小SO2的浓度能加快反应速率 | D. | 反应中SO2能100%转化为SO3 |
1.下列各组离子在溶液中能够大量共存的是( )
| A. | H+、Fe2+、Na+、ClO- | B. | Cu2+、Ba2+、OH-、Cl- | ||
| C. | Ca2+、K+、Al3+、CO32- | D. | NH4+、NO3-、Na+、SO42- |
8.下列措施中,不能有效减缓金属腐蚀的是( )
| A. | 金属护栏表面涂漆 | B. | 地下钢管连接镁块 | ||
| C. | 汽车底盘喷涂高分子膜 | D. | 水中的钢闸门连接电源的正极 |
5.已知:Pb元素在化合物中有+4和+2两种价态:Pb02受热分解可生成Pb304、Pb0和O2:+4价的Pb能氧化浓盐酸生成Cl2 PbO能与浓盐酸反应但不能将其氧化.现将1.4mol Pb02加热一段时间分解得到O2和固体甲,向甲中加入足量的浓盐酸得到Cl2.反应生成的O2和Cl2的物质的盘之比为2:3,下列说法正确的是 ( )
| A. | 甲可能是Pb304和PbO的混合物 | |
| B. | 整个反应过程中转移电子的总量为2.1mol | |
| C. | 若甲与浓盐酸充分反应,则需要消耗HCl的总量为2.8 mol | |
| D. | 甲中各物质的物质的量之比可能是n(PbO2):n(Pb304):n(PbO)=3:3:2 |
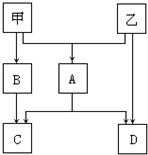 甲、乙是两种常见短周期元素的单质,其有关化合物的性质如图所示,其中C为白色沉淀,D为气体.
甲、乙是两种常见短周期元素的单质,其有关化合物的性质如图所示,其中C为白色沉淀,D为气体.