题目内容
已知:11P4(白磷)+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4,若有9 mol的CuSO4参加反应,则被硫酸铜氧化的白磷分子的物质的量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:氧化还原反应的计算,氧化还原反应
专题:氧化还原反应专题
分析:Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,结合电子守恒来解答.
解答:
解:Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,
则由电子守恒可知,有9 mol的CuSO4参加反应,则被硫酸铜氧化的白磷分子的物质的量为
=
,
故选B.
则由电子守恒可知,有9 mol的CuSO4参加反应,则被硫酸铜氧化的白磷分子的物质的量为
| 9mol×(2-1) |
| 4×(5-0) |
| 9 |
| 20mol |
故选B.
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子守恒计算的考查,题目难度不大.

练习册系列答案
相关题目
根据元素周期表和元素周期律,下列推断中错误的是( )
| A、砹是一种有色固体,它的气态氢化物很不稳定 |
| B、F2与水反应比Cl2与水反应剧烈 |
| C、铷的硫酸盐易溶解于水,其氢氧化物一定是弱碱 |
| D、氯化氢比溴化氢稳定,HClO4酸性强于HBrO4 |
A、B、C、D、E是元素周期表中的短周期主族元素,且原子序数依次增大.已知A与B不在同周期,A与C同主族,B原子最外层电子数是其电子层数的2倍,A、C、E原子最外层电子数之和为6,D的氧化物具有两性.下列说法正确的是( )
| A、A、B只能形成一种化合物 |
| B、离子半径:C<D |
| C、气态氢化物的稳定性:B>E |
| D、元素C、D的最高价氧化物对应水化物之间不能发生反应 |
在无色透明的溶液中可以大量共存的离子组是( )
| A、OH-、K+、Al3+ |
| B、OH-、Cl-、NH4+ |
| C、Cu2+、NO3-、Cl- |
| D、Mg2+、K+、Cl- |
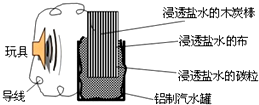 利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置,如图就是用一个废旧材料制作的可用于驱动玩具电池的示意图.该电池工作时有关说法正确的是( )
利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置,如图就是用一个废旧材料制作的可用于驱动玩具电池的示意图.该电池工作时有关说法正确的是( )| A、铝罐将逐渐被腐蚀 |
| B、该装置实现了化学能向电能的转化 |
| C、炭棒应与玩具电机的负极相连 |
| D、该电池工作一段时间后炭棒和炭粒的质量会减轻 |
下列说法正确的是( )
| A、固体氯化钠不导电,所以氯化钠不是电解质 |
| B、液态氯化氢能导电 |
| C、铜丝能导电,所以铜是电解质 |
| D、液态氯化钠能导电 |
下列基态原子的电子构型中,正确的是( )
| A、3d94s2 |
| B、3d44s2 |
| C、3d104s0 |
| D、3d83s2 |
某碱性蓄电池在充电和放电时发生的反应为:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2,下列说法中正确的是( )
| 充电 |
| 放电 |
| A、放电时,负极上发生反应的物质是NiO2 |
| B、放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 |
| C、充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O |
| D、充电时,阳极附近pH值减小 |
下列各组中的离子,能在强酸性溶液中大量共存的是( )
| A、Mg2+、SO42-、K+ |
| B、CO32-、Na+、NO3- |
| C、Al3+、CO32-、OH- |
| D、NO3-、Ag+、Cl- |