题目内容
在容积不变的密闭容器中存在反应:2A(g)+B(g)
2C(g)△H<0;某研究小组研究了只改变某一反应条件对上述反应的影响,下列说法正确的是( )
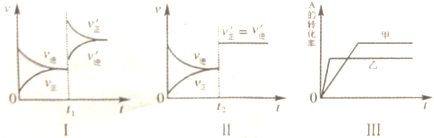
| 催化剂 |
| 加热 |

| A、图Ⅰ表示的是t1时刻增大B的浓度对反应速率的影响 |
| B、图Ⅱ表示的是t2时刻加入催化剂后对反应速率的影响 |
| C、图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 |
| D、图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
考点:化学反应速率与化学平衡图象的综合应用,转化率随温度、压强的变化曲线
专题:化学平衡专题
分析:图Ⅰ正逆反应速率都增大,且平衡仍向正反应方向移动,应为增大压强;图Ⅱ正逆反应速率都增大,且平衡不移动,应为加入催化剂;图Ⅲ乙反应速率较大,但A的转化率较小,说明平衡向逆反应移动,可为升高温度的影响.
解答:
解:A.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大,图Ⅰ应是增大压强的原因,故A错误;
B.图Ⅱ在t2时刻正逆反应速率都增大,但仍相等,平衡不发生移动,应是加入催化剂的原因,故B正确;
C.图III甲、乙两个平衡状态不同,而加入催化剂,平衡不发生移动,故C错误;
D.图Ⅲ乙反应速率较大,如是增大压强,则平衡向正方向移动,A的转化率增大,故D错误.
故选B.
B.图Ⅱ在t2时刻正逆反应速率都增大,但仍相等,平衡不发生移动,应是加入催化剂的原因,故B正确;
C.图III甲、乙两个平衡状态不同,而加入催化剂,平衡不发生移动,故C错误;
D.图Ⅲ乙反应速率较大,如是增大压强,则平衡向正方向移动,A的转化率增大,故D错误.
故选B.
点评:本题考查外界条件对化学反应速率、化学平衡的影响,题目难度中等,答题时注意:
(1)若t0时刻无断点,则平衡移动肯定是改变某一物质的浓度导致.
(2)若t0时刻有断点,则平衡移动可能是由于以下原因所导致:①同时不同程度地改变反应物(或生成物)的浓度;
②改变反应体系的压强;③改变反应体系的温度.
(3)若平衡无移动,则可能是由于以下原因所导致:①反应前后气体分子个数不变;②使用了催化剂.
(4)若V正在V逆的上方,即平衡向正反应方向移动;若V正在V逆的下方,即平衡向逆反应方向移动.
(1)若t0时刻无断点,则平衡移动肯定是改变某一物质的浓度导致.
(2)若t0时刻有断点,则平衡移动可能是由于以下原因所导致:①同时不同程度地改变反应物(或生成物)的浓度;
②改变反应体系的压强;③改变反应体系的温度.
(3)若平衡无移动,则可能是由于以下原因所导致:①反应前后气体分子个数不变;②使用了催化剂.
(4)若V正在V逆的上方,即平衡向正反应方向移动;若V正在V逆的下方,即平衡向逆反应方向移动.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
实验必须注意安全,下列说法不正确的是( )
| A、如果苯酚浓溶液沾到皮肤上,应立即用酒精洗涤 |
| B、在点燃H2、CH4等易燃性气体前,必须检验气体的纯度 |
| C、实验室蒸馏原油时,要加入碎瓷片防止液体暴沸 |
| D、石油的分馏时,温度计的水银球要插到液面下 |
下列说法正确的是( )
| A、固体氯化钠不导电,所以氯化钠不是电解质 |
| B、液态氯化氢能导电 |
| C、铜丝能导电,所以铜是电解质 |
| D、液态氯化钠能导电 |
1mol O3和1molO2具有相同的( )
| A、分子数 | B、原子数 |
| C、质子数 | D、电子数 |
某碱性蓄电池在充电和放电时发生的反应为:Fe+NiO2+2H2O
Fe(OH)2+Ni(OH)2,下列说法中正确的是( )
| 充电 |
| 放电 |
| A、放电时,负极上发生反应的物质是NiO2 |
| B、放电时,正极反应是:NiO2+2e-+2H+=Ni(OH)2 |
| C、充电时,阴极反应是:Ni(OH)2-2e-+2OH-=NiO2+2H2O |
| D、充电时,阳极附近pH值减小 |
若溶液中由水电离产生的c(OH-)=1×10-14mol?L-1,满足此条件的溶液中一定能大量共存的离子组是( )
| A、Al3+ Na+ NO3- Cl- |
| B、K+ Na+ Cl- NO3- |
| C、K+ Na+ Cl- HCO3- |
| D、K+ Fe2+ SO42- NO3- |
瑞典皇家科学院把2010年诺贝尔化学奖授予在“钯催化交叉偶联反应”领域做出突出贡献的三位化学家.下列有关钯原子(
Pd)的说法正确的是( )
106 46 |
| A、质量数为46 |
| B、质子数为106 |
| C、电子数为46 |
| D、中子数为106 |
下列状态的物质,既能导电又属于电解质的是( )
| A、MgCl2晶体 |
| B、熔融的NaCl |
| C、液态酒精 |
| D、KOH溶液 |