题目内容
11.加热16.8gNaHCO3至没有气体放出时,剩余的物质是什么?计算剩余物质的质量和物质的量.(1)加热NaHCO3时发生的化学反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
(2)剩余的物质是Na2CO3,质量为10.6g,物质的量为0.1mol.(写出计算过程)
分析 发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,n(NaHCO3)=$\frac{16.8g}{84g/mol}$=0.2mol,结合反应计算.
解答 解:(1)加热NaHCO3时发生的化学反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(2)n(NaHCO3)=$\frac{16.8g}{84g/mol}$=0.2mol,则
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
2 1
0.2mol n(Na2CO3)
n(Na2CO3)=0.1mol,
m(Na2CO3)=0.1mol×106g/mol=10.6g,
即剩余物质是Na2CO3,质量为10.6g,物质的量为0.1mol,
故答案为:Na2CO3;10.6g;0.1mol.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意物质的量的相关计算,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
20.下列说法正确的是( )
| A. | 苯的同系物都能使酸性高锰酸钾溶液褪色 | |
| B. | 红外光谱、核磁共振氢谱都可以鉴别乙醇和甲醚 | |
| C. | 符合相同通式的不同物质一定是同系物 | |
| D. | 某有机物燃烧后只生成二氧化碳和水,则一定不含有氧元素 |
1.设NA为阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 2.4g金属镁所含电子数目为0.2NA | |
| B. | 7.8gNa2O2中含有阴离子数目为0.2NA | |
| C. | 71g氯气溶于水配成溶液,所得溶液中含Cl-数目为1 NA | |
| D. | 4℃,18g水所含分子数目为NA |
6.1.52g 铜镁合金恰好溶解于14.0mol/L的浓硝酸中,向反应后的溶液中加入0.1mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.则加入NaOH溶液的体积是( )
| A. | 400 mL | B. | 600 mL | C. | 500 mL | D. | 480 mL |
16.实验室常用氯化铵与氢氧化钙的固体混合加热制取氨气,实验室提供的有关装置见表:
完成下列填空:
(1)从图中选择实验室制取氨气的发生装置b(选填编号)、收集装置①(选填编号).
(2)用注射器收集50mL纯净的氨气,然后再抽取10mL滴有酚酞试液的蒸馏水,并用橡皮塞封闭针头.充分振荡后注射器内无(选填“有”“无”)气体剩余,液体呈红色,用化学方程式解释液体颜色变化的原因NH3+H2O?NH3•H2O?NH4++OH-.
(3)工业合成氨的简易流程如图:
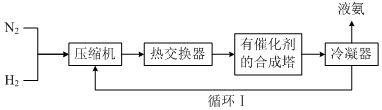
通过循环Ⅰ可利用的气态物质是d
a.催化剂 b.只有N2c.只有H2 d.N2和H2
(4)将 CO2通入到氨化的饱和食盐水中制备NaHCO3固体,反应的化学方程式NaCl+CO2+NH3+H2O→NaHCO3↓+NH4Cl.29NH3、PH3、
AsH3三种氢化物热稳定性由强到弱的顺序是NH3>PH3>AsH3,理由是N、P、As原子半径依次增大,使得N-H、P-H、As-H键长依次增长,热稳定性逐渐减弱.
(5)工业上用氨水吸收SO2尾气,最终得到化肥 (NH4)2SO4.(NH4)2SO4溶液呈酸性,用离子方程式解释原因NH4++H2O=NH3•H2O+H+;该溶液中存在多种守恒,用离子浓度表示其中一种守恒关系电荷守恒为:[NH4+]+[H+]=2[SO42-]+[OH-]或者物料守恒为:2[SO42-]=[NH4+]+[NH3•H2O].
| 气体发生装置 | 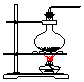 a | 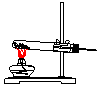 b |  c |
| 气体收集装置 |  2 | 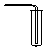 ② | 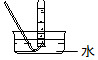 ③ |
(1)从图中选择实验室制取氨气的发生装置b(选填编号)、收集装置①(选填编号).
(2)用注射器收集50mL纯净的氨气,然后再抽取10mL滴有酚酞试液的蒸馏水,并用橡皮塞封闭针头.充分振荡后注射器内无(选填“有”“无”)气体剩余,液体呈红色,用化学方程式解释液体颜色变化的原因NH3+H2O?NH3•H2O?NH4++OH-.
(3)工业合成氨的简易流程如图:

通过循环Ⅰ可利用的气态物质是d
a.催化剂 b.只有N2c.只有H2 d.N2和H2
(4)将 CO2通入到氨化的饱和食盐水中制备NaHCO3固体,反应的化学方程式NaCl+CO2+NH3+H2O→NaHCO3↓+NH4Cl.29NH3、PH3、
AsH3三种氢化物热稳定性由强到弱的顺序是NH3>PH3>AsH3,理由是N、P、As原子半径依次增大,使得N-H、P-H、As-H键长依次增长,热稳定性逐渐减弱.
(5)工业上用氨水吸收SO2尾气,最终得到化肥 (NH4)2SO4.(NH4)2SO4溶液呈酸性,用离子方程式解释原因NH4++H2O=NH3•H2O+H+;该溶液中存在多种守恒,用离子浓度表示其中一种守恒关系电荷守恒为:[NH4+]+[H+]=2[SO42-]+[OH-]或者物料守恒为:2[SO42-]=[NH4+]+[NH3•H2O].
3.向a mL0.25mol•L-1的AlCl3溶液中加入金属钠,反应完全后,恰好只形成NaCl和NaAlO2的混合溶液,则加入金属钠的物质的量为( )
| A. | 2.5a×10-4mol | B. | a×10-3mol | C. | 7.5a×10-4mol | D. | a×10-4mol |
1.下列关于金属钠的叙述中,说法正确的是( )
| A. | 钠在空气中燃烧,发出黄色火焰 | |
| B. | 钠在空气中燃烧,产物是Na2O | |
| C. | 钠是银白色金属,硬度大,熔点高 | |
| D. | 取用金属钠时,剩余的钠不能放回原瓶 |