题目内容
下列水解的离子方程式正确的是( )
| A、S2-+2H2O?H2S+2OH- |
| B、Fe3++3H2O?Fe(OH)3+3H+ |
| C、HCO3-+H2O?CO32-+H3O+ |
| D、HS-+H2O?H2S↑+OH- |
考点:离子方程式的书写
专题:
分析:A.硫离子的水解过程分步进行,水解方程式主要以第一步为主;
B.铁离子水解生成氢氧化铁和氢离子,其水解的离子方程式一步完成;
C.碳酸氢根离子水解生成碳酸和氢氧根离子;
D.水解程度较小,生成的硫化氢不能使用气体符号.
B.铁离子水解生成氢氧化铁和氢离子,其水解的离子方程式一步完成;
C.碳酸氢根离子水解生成碳酸和氢氧根离子;
D.水解程度较小,生成的硫化氢不能使用气体符号.
解答:
解:A.硫离子在溶液中水解以第一步为主,水解生成硫氢根离子和氢氧根离子,正确的水解方程式为:S2-+H2O?HS-+OH-,故A错误;
B.铁离子结合水电离的氢氧根离子生成氢氧化铁,水解方程式为:Fe3++3H2O?Fe(OH)3+3H+,故B正确;
C.碳酸氢根离子水解生成碳酸和氢氧根离子,正确的水解方程式为:HCO3-+H2O?H2CO3+OH-,故C错误;
D.硫氢根离子水解生成硫化氢和氢氧根离子,由于水解程度较小,不能使用气体符号,正确的水解方程式为:HS-+H2O?H2S↑+OH-,故D错误;
故选B.
B.铁离子结合水电离的氢氧根离子生成氢氧化铁,水解方程式为:Fe3++3H2O?Fe(OH)3+3H+,故B正确;
C.碳酸氢根离子水解生成碳酸和氢氧根离子,正确的水解方程式为:HCO3-+H2O?H2CO3+OH-,故C错误;
D.硫氢根离子水解生成硫化氢和氢氧根离子,由于水解程度较小,不能使用气体符号,正确的水解方程式为:HS-+H2O?H2S↑+OH-,故D错误;
故选B.
点评:本题考查了水解原理、水解方程式的书写判断,题目难度中等,注意掌握水解原理及水解方程式的书写原则,明确多元弱酸根离子的水解分步进行,主要以第一步为主,多元弱碱根离子的水解一步到位即可.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
某温度下,反应H2(g)+I2(g) 2HI(g);△H>0.在一带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
| A、恒温,压缩体积,平衡不移动,混合气体颜色加深 |
| B、恒压,充入HI(g),开始时正反应速率减小 |
| C、恒容,升高温度,逆反应速率减小 |
| D、恒容,充入H2,再次达到平衡时H2(g)的体积分数增大 |
某同学用如图所示装置进行铜的电解精炼实验(粗铜中有锌、铁、镍、银等杂质,部分导线未画出),下列说法正确的是( )


| A、a应与c相连接,b应与d相连接 |
| B、电解一段时间,b与d两极析出物质的物质的量相等 |
| C、电解一段时间,b极附近溶液的pH降低 |
| D、电解过程中,Y装置中Cu2+的浓度始终不变 |
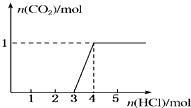 一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )
一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是( )| A、通入的CO2气体在标准状况下等于11.2 L |
| B、溶液中n(NaOH)=2n(Na2CO3) |
| C、A溶液中既含Na2CO3,又含NaHCO3 |
| D、A溶液中一定只有Na2CO3 |
下列离子方程式中书写正确的是( )
| A、硫酸镁溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
| B、铁和稀硫酸反应:2Fe+6H+═2Fe 3++3H2↑ |
| C、铜和硝酸银溶液反应:Cu+Ag+═Cu2++Ag |
| D、碳酸钙和稀盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
关于NaOH溶液和Fe(OH)3胶体描述正确的是( )
| A、两者的分散质都属于碱 |
| B、两者均为有色不透明的分散系 |
| C、两者分散质的直径都介于10-9~10-7m之间 |
| D、一束光线分别通过时,两者都会产生“丁达尔效应” |
如果Fe3+、SO42-、Al3+和M四种离子以物质的量之比为2:4:1:1共同存在于同一种溶液中,那么M可能是( )
| A、Na+ |
| B、PO43- |
| C、CO32- |
| D、Cl- |
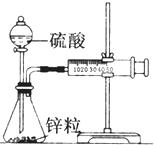 某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.
某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.