题目内容
16.下列说法中正确的是( )| A. | 3p2表示3p能级有两个轨道 | |
| B. | 1s22s12p1表示的是激发态原子的电子排布 | |
| C. | M能层中的原子轨道数目为3 | |
| D. | 处于同一轨道上的电子可以有多个,它的运动状态完全相同 |
分析 A.p能级有3个原子轨道;
B.原子的核外电子排布符合能量最低原理、泡利不相容原理及洪特规则,原子处于基态,否则为激发态;
C.M层有s、p、d能级,s能级有1个轨道、p能级有3个轨道、d能级有5个轨道;
D.同一轨道上最多排2个电子,其运动状态不同.
解答 解:A.3p能级有三个轨道,3p2表示3p能级有两个电子,而不是两个轨道,故A错误;
B.91s22s12p1,根据能量最低原理,其基态应为1s22s2,1个2s电子被激发到2p能级上为激发态,故B正确;
C.M层有s、p、d能级,s能级有1个轨道、p能级有3个轨道、d能级有5个轨道,轨道数=1+3+5=9,故C错误;
D.同一轨道上最多排2个电子,其自旋方向相反,所以它们的状态并不完全相同,故D错误;
故选B.
点评 本题考查原子核外能级分布,明确原子核外电子层顺序、每个电子层上能级分布即可解答,熟练掌握每个能级中轨道数,题目难度不大.

练习册系列答案
相关题目
4.下列过程一定吸收热量的是( )
| A. | 化学反应过程中形成新的化学键 | B. | 干冰升华 | ||
| C. | 加热才能发生的化学反应 | D. | 氧化钙与水反应 |
11.常温下,下列各组微粒在指定的溶液中一定能大量共存的是( )
| A. | 加入金属镁产生H2的溶液中:NH4+、Na+、SO42-、CH3COO- | |
| B. | 含有大量ClO-的溶液中:K+、Na+、NO3-、SO42- | |
| C. | c(Cu2+)=0.1 mol•L-1的溶液中:H+、NH4+、Br-、CO32- | |
| D. | 含有大量MnO4-的溶液中:H+、SO42-、Cl-、CH3CH2OH |
1.下列有关化学反应表达正确的是( )
| A. | 实验室用液溴和苯在催化剂作用下制溴苯: | |
| B. | 丙烯制备聚丙烯: | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+NaOH→CH2BrCOONa+H2O | |
| D. | 苯酚钠溶液通入少量的CO2: -O-+CO2+H2O -O-+CO2+H2O -OH+HCO3- -OH+HCO3- |
5.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )

| A. | ZY、ZW 的水溶液都显酸性 | |
| B. | 原子半径大小:W>R>X,离子半径大小:Z+>R2->W->Y- | |
| C. | W 的氢化物水溶液的酸性比 R 的氢化物水溶液的酸性强,可证明非金属性:W>R | |
| D. | Z、X 两种元素可形成的 Z2X、Z2X2等多种离子化合物 |
6.2008年北京奥运会的游泳中心(水立方)的建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成全氟乙丙烯.下列说法正确的是( )
| A. | 聚四氟乙烯有固定的熔点 | |
| B. | 合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应 | |
| C. | 聚全氟乙丙烯分子的结构简式可能为 | |
| D. | ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方式 |
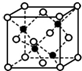 前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.
前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族.F是第四周期未成对电子最多的原子,G是目前使用量最多的金属.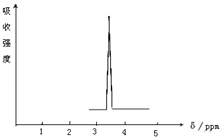 (1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是AD.
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是AD.