题目内容
17.能正确表示下列反应的离子方程式是( )| A. | Fe( NO3)3溶液中加入过量HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 浓烧碱溶液中加入铝片:2A1+2OH-═2AlO2-+H2 | |
| C. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4+H2O | |
| D. | 将新制氢氧化铜悬浊液加入氨水中:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O |
分析 A.碘化氢过量,硝酸根离子、三价铁离子都被还原;
B.氧原子个数不守恒;
C.离子个数配比不符合物质结构;
D.二者发生络合反应生成可溶性络合物和水.
解答 解:A.硝酸铁溶液中滴加足量HI溶液,铁离子和硝酸根离子都参与反应,正确的离子方程式为:Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO↑+6H2O,故A错误;
B.NaOH溶液和铝片的反应与氢氧化钠量的多少没有关系,往过量和少量NaOH溶液中投入铝片均发生反应:2Al+2OH-+2H2O═2AlO2-+3H2↑,故B错误;
C.H2SO4与Ba(OH)2溶液反应,离子方程式:Ba2++2OH-+2H++SO42-═BaSO4+2H2O,故C错误;
D.将新制氢氧化铜悬浊液加入氨水中,离子方程式:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意离子反应遵循客观事实、电荷原子个数守恒规律,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8. 甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )
甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )
 甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )
甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )| A. | A2B3 | B. | A3B2 | C. | AB2 | D. | A2 |
5.由下列实验事实得出的结论正确的是( )
| A. | 由SiO2不能与水反应生成H2SiO3,可知SiO2不是H2SiO3的酸酐 | |
| B. | 由SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,可知碳的非金属性大于硅 | |
| C. | CO2通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3 | |
| D. | SiO2可与NaOH溶液反应,也可与氢氟酸反应,可知SiO2为两性氧化物 |
2.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
6.发生在美国的墨西哥湾原油泄漏事件极大地破坏了生态环境,该事件警示人类应合理的开发和利用能源.随着经济的飞速发展,机动车越来越多,对石油产品的需求激增,为了环保和降低成本,很多国家转型研究电动车.LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质,电池反应为:FePO4+Li$?_{充电}^{放点}$LiFePO4.下列有关LiFePO4电池说法正确的是( )
| A. | 可加入烧碱溶液以提高电池的性能,碱性电池的能量和可储存时间均较高 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 充电过程中,电池正极材料的质量减少 | |
| D. | 放电时电池正极反应为:FePO4+Li+-e-═LiFePO4 |
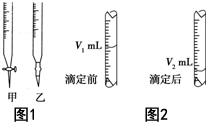 现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白: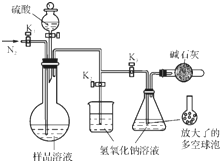 碳酸钠-过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:
碳酸钠-过氧化氢加合物(aNa2CO3•bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下: 清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.
清洁能源具有广阔的开发和应用前景,可减少污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.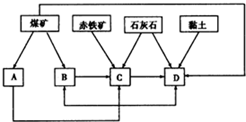 我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土.拟在该地区建设大型炼铁厂.
我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土.拟在该地区建设大型炼铁厂.