题目内容
12.材料是经济和生态文明建设的重要物质基础.①生产硅酸盐水泥和普通玻璃都需用到的共同原料是石灰石.
②橡胶是制造轮胎的重要原料,橡胶属于C(填字母).
A.金属材料 B.无机非金属材料 C.有机高分子材料
③钢铁制品在潮湿的空气中能发生电化学腐蚀.发生该腐蚀时的负极反应式为Fe-2e-=Fe2+.
分析 ①水泥的原料是粘土和石灰石,玻璃的原料是纯碱、石灰石和石英,所以原料中均有石灰石;
②橡胶有天然的和人工合成的,都是高分子材料;
③钢铁是铁的合金易发生电化学腐蚀;Fe失电子作负极.
解答 解:①生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;
生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥;所以在玻璃工业、水泥工业中都用到的原料是石灰石,
故答案为:石灰石(或CaCO3);
②橡胶分为天然橡胶和合成橡胶,天然橡胶的成分是聚异戊二烯 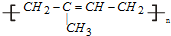 ,合成橡胶主要指:顺丁橡胶、氯丁橡胶、丁苯橡胶等,都为有机高分子材料,
,合成橡胶主要指:顺丁橡胶、氯丁橡胶、丁苯橡胶等,都为有机高分子材料,
故答案为:C;
③钢铁是铁的合金在潮湿的空气中易发生电化学腐蚀;Fe失电子作负极,Fe失去电子生成二价铁离子,其电极反应为:Fe-2e-=Fe2+;
故答案为:电化学;Fe-2e-=Fe2+.
点评 本题考查化学与环境、材料、信息、能源关系密切相关的知识,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大.

练习册系列答案
 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
19.下列各组溶液中的离子,因发生氧化还原反应而不能大量共存在溶液中的是( )
| A. | H+、Ca2+、NO3-、CO32- | B. | K+、H+、Fe2+、NO3- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | NH4+、K+、OH-、SO42- |
20.下列判断正确的是( )
| A. | 取样品进行焰色反应,火焰显黄色,说明有Na元素存在,无K元素 | |
| B. | 向某溶液中滴入稀盐酸立即产生使澄清石灰水变浑浊的气体,说明有CO32-存在 | |
| C. | 向某溶液中滴入KSCN溶液不变色,再滴入几滴氯水变红,说明存在Fe2+,无Fe3+ | |
| D. | 向某溶液中滴加过量Ba(0H)2溶液,最终有白色沉淀,说明无Al3+ |
17.设NA为阿伏加德罗的值,则下列说法正确的是( )
| A. | 标准状况下,22.4L H2S和SO2的混合气体中含有的分子总数为NA | |
| B. | 1 L pH=1的醋酸溶液中,CH3COO-和OH-数目之和为0.1NA | |
| C. | 78g苯中含有碳碳双键的数目为3NA | |
| D. | 6.72L NO2与水充分反应转移的电子数目为0.2NA |
4.短周期元素W、X、Y、Z 的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体.下列说法正确的是( )
| A. | Y的最高价氧化物对应水化物的酸性比W的强 | |
| B. | W的气态氢化物比X的稳定 | |
| C. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| D. | XY2与ZY2中的化学键类型相同 |
2.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,2.24LCl2溶于水,转移的电子数目为0.05NA | |
| B. | 常温下,1 L0.1mol/L的Na2CO3溶液中含有的CO32-离子数为0.1NA | |
| C. | 标准状况下,22.4 L CO和NO的混合气体中所含的氧原子总数为NA | |
| D. | 将含有1mol FeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目为 NA |