题目内容
12.化学与生产、生活息息相关,下列叙述正确的是( )| A. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 | |
| B. | 用聚乳酸塑料代替聚乙烯塑料能减少白色污染 | |
| C. | 金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
分析 A.正反应放热,升高温度,平衡逆向移动;
B.聚乳酸可降解;
C.金属汞污染土壤;
D.浓硫酸与铁反应不生成氢气.
解答 解:A.正反应放热,升高温度,反应速率增大,但平衡逆向移动,平衡常数减小,故A错误;
B.聚乳酸可降解,而聚乙烯不降解,可减少白色污染,故B正确;
C.金属汞污染土壤,不能埋于地下,可用硫处理,故C错误;
D.浓硫酸具有强氧化性,与铁反应不生成氢气,故D错误.
故选B.
点评 本题考查较为综合,涉及化学与生活、环境以及健康等知识,为高考常见题型,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
相关题目
5.下列有关实验的说法正确的是( )
| A. | 为测定熔融氢氧化钠的导电性,可在氧化铝坩埚中熔化氢氧化钠固体后进行测量 | |
| B. | Fe(OH)3胶体可以将Fe Cl3滴入NaOH溶液中进行制备 | |
| C. | 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| D. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
6.电解硫酸铜溶液要达到如下三个要求:①阳极质量减小 ②阴极质量增加 ③电解过程中Cu2+浓度不变,则可选用的电极是( )
| A. | 石墨作阳极,铁作阴极 | |
| B. | 粗铜(含Fe、Ni、Zn)作阳极,纯铜作阴极 | |
| C. | 纯铜作阳极,铁作阴极 | |
| D. | 铁作阳极,纯铜作阴极 |
4.下列分子是极性分子的是( )
| A. | PCl5 | B. | SO2 | C. | BF3 | D. | CS2 |
1.下列离子方程式不正确的是( )
| A. | 向100mL0.1mol•L-1的Na2CO3溶液中滴加含0.01molCH3COOH的醋酸溶液CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 4mol•L-1的NaAlO2溶液和7mol•L-1的盐酸等体积均匀混合4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 等物质的量的FeBr2与Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | 将少量SO2通入NaClO溶液中:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
2.分析生产生活中的下列过程,不涉及氧化还原反应的是( )
| A. | 从海水中提取镁 | B. | 用酒精测试仪检测酒驾 | ||
| C. | 将氯气通入冷的消石灰中制漂白粉 | D. | 石油分馏 |
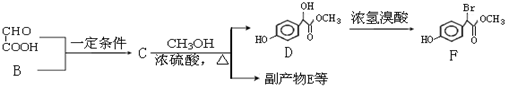
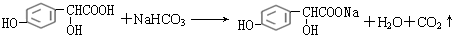 .
. .
.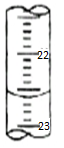 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: