题目内容
4.下列分子是极性分子的是( )| A. | PCl5 | B. | SO2 | C. | BF3 | D. | CS2 |
分析 正负电荷重心重合为非极性分子,正负电荷重心不重合为极性分子,结合分子空间构型判断,对于ABn型分子,中心原子A的最外层电子全部成键,为非极性分子,中心原子A的最外层电子部分成键,为极性分子,据此结合选项解答.
解答 解:A.PCl5分子中P元素的最外层电子数为5,化合价为+5,最外层电子全部成键,是非极性分子,故A不选;
B.SO2分子中S元素的最外层电子数为6,化合价为+4,最外层电子未全部成键,是极性分子,故B选;
C.BF3的空间结构为平面三角形,结构对称,正负电荷的中心重合,属于非极性分子,故C不选;
D.CS2为直线形,结构对称,正负电荷的中心重合,属于非极性分子,故D不选.
故选B.
点评 本题考查极性分子和非极性分子,熟悉常见元素之间的成键是解答本题的关键,注意化学键与分子的极性的关系来分析解答即可,难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
18.现有等质量的两份固体,其化学式为Na2CO3•2NaHCO3•3H2O.一份与足量的盐酸反应收集到气体体积为V1L(标准状况),另一份固体在空气中灼烧至恒重,再与足量稀硫酸反应产生气体体积为V2L(标准状况).则V1:V2为( )
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 3:1 |
12.化学与生产、生活息息相关,下列叙述正确的是( )
| A. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 | |
| B. | 用聚乳酸塑料代替聚乙烯塑料能减少白色污染 | |
| C. | 金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
19.我国酸雨形成的主要原因是( )
| A. | 石油、天然气等燃烧产生大量二氧化碳 | |
| B. | 大量燃烧含硫量高的煤产生二氧化硫 | |
| C. | 森林遭到乱砍烂伐,破坏了生态环境 | |
| D. | 各种机动车排放的尾气 |
9.下列各有机物的名称错误的是( )
| A. | 3-甲基-2-戊烯 | B. | 3-甲基-2-丁烯 | C. | 2,2-二甲基丙烷 | D. | 3-甲基-1-丁炔 |
16.下列叙述正确的是( )
| A. | 1 mol H2SO4 的质量为98 g•mol-1 | |
| B. | H2SO4的摩尔质量为98 g | |
| C. | 9.8 g H2SO4含有NA个H2SO4分子 | |
| D. | 6.02×1022个H2SO4分子的质量为9.8 g |
14.下列有关电解质溶液的说法正确的是( )
| A. | 向0.1mol•L-1氨水中加入少量水,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减少 | |
| B. | 将NH4Cl溶液从20℃升温至30℃,溶液中$\frac{c(N{H}_{4})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$增大 | |
| C. | 向氢氧化钠溶液中加入醋酸至中性,溶液中$\frac{c(C{H}_{3}COO)}{c(N{a}^{+})}$=1 | |
| D. | 向含有BaSO4、BaCO3的饱和溶液中加入少量的Ba(NO3)2,溶液中的$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$减小 |
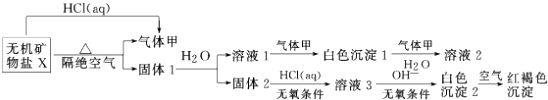
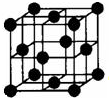 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:
早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题: