题目内容
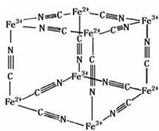 普鲁士蓝晶体结构如下图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )
普鲁士蓝晶体结构如下图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),下列说法正确的是( )| A、化学式可以表示为KFe2(CN)6 |
| B、一个立方体中含有12个π键 |
| C、普鲁士蓝中含有配位键 |
| D、Fe3+周围有12个Fe2+离子 |
考点:晶胞的计算
专题:化学键与晶体结构
分析:A、利用均摊法计算普鲁士蓝化学式;
B、每个CN-含有2个π键,每个立方体中含有CN-个数为3,所以一个立方体中含有6个π键;
C、普鲁士蓝中Fe3+与CN-形成配位键;
D、Fe3+周围的Fe2+离子在顶点上.
B、每个CN-含有2个π键,每个立方体中含有CN-个数为3,所以一个立方体中含有6个π键;
C、普鲁士蓝中Fe3+与CN-形成配位键;
D、Fe3+周围的Fe2+离子在顶点上.
解答:
解:A、每隔一个立方体中心有一个钾离子,所以一个晶胞中钾离子个数=1÷2=0.5,该立方体中铁原子个数=8×
=1,CN-位于每条棱中点,该立方体中含有CN-个数=12×
=3,所以平均化学式是K 0.5 Fe(CN)3,化学式可以表示为KFe2(CN)6,故A正确;
B、每个CN-含有2个π键,每个立方体中含有CN-个数为3,所以一个立方体中含有6个π键,故B错误;
C、普鲁士蓝中Fe3+含有空轨道,CN-中N原子提供孤电子对,形成配位键,故C正确;
D、普鲁士蓝中Fe3+周围Fe2+离子个数为3×8×
=3个,故D错误.
故选:AC.
| 1 |
| 8 |
| 1 |
| 4 |
B、每个CN-含有2个π键,每个立方体中含有CN-个数为3,所以一个立方体中含有6个π键,故B错误;
C、普鲁士蓝中Fe3+含有空轨道,CN-中N原子提供孤电子对,形成配位键,故C正确;
D、普鲁士蓝中Fe3+周围Fe2+离子个数为3×8×
| 1 |
| 8 |
故选:AC.
点评:本题考查了晶胞的计算等知识点,难点是亚铁离子和铁离子个数比,利用平均化合价解答即可,难度中等.

练习册系列答案
相关题目
高温下,某反应达到平衡,平衡常数K=
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、该反应是焓变为正值 | |||
| B、增大压强,H2浓度一定减小 | |||
| C、升高温度,逆反应速率减小 | |||
D、该反应化学方程式为CO+H2O
|
下列营养物质在人体内发生的变化及其对生命活动所起的作用叙述不正确的是( )
| A、淀粉→葡萄糖→(氧化)水和二氧化碳(释放能量维持生命活动) |
| B、纤维素(水解)→葡萄糖→(氧化)水和二氧化碳(释放能量维持生命活动) |
| C、油脂→(水解)甘油和高级脂肪酸→(氧化)水和二氧化碳(释放能量维持生命活动) |
| D、蛋白质→(水解)氨基酸氨基酸→(合成)人体所需的蛋白质(人体生长发育) |