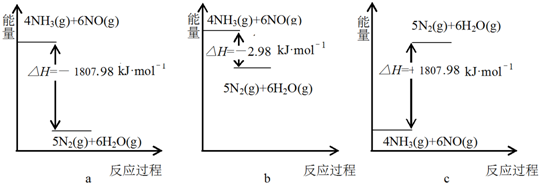
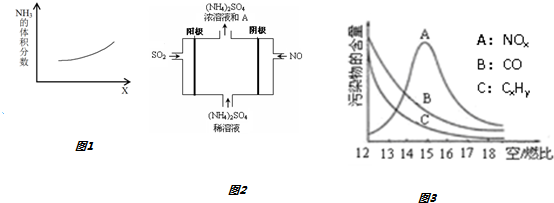
题目内容
16.氯元素是生产生活中常见的非金属元素.某同学探究Cl2及其化合物的性质.(1)把Cl2通入水中,反应的化学方程式是Cl2+H2O?HCl+HClO.
(2)用氯水进行如下表实验:
| 实验 | 操作 | 现象 |
| Ⅰ | 把氯水点在蓝色石蕊试纸上 | 试纸先变红后褪色 |
| Ⅱ | 向氯水中滴加足量AgNO3溶液,不断振荡 | ⅰ.有白色沉淀生成 ⅱ.稍后,溶液变为无色 |
②实验Ⅱ:a.ⅰ现象的白色沉淀是AgCl.
b.综合ⅰ、ⅱ现象,该同学推测实验Ⅱ发生的反应为:
Cl2+AgNO3+H2O=HNO3+AgCl↓+HClO(将反应补充完整)
③为探究实验Ⅰ中试纸褪色的原因及Ⅱ中另一种反应产物,该同学设计实验如下:
c.将少量稀硝酸点在蓝色石蕊试纸上,试纸变红未褪色;
d.…
上述实验d的方案是取实验Ⅱ中ⅱ的无色溶液,点在蓝色石蕊试纸上,试纸褪色.
(3)该同学查阅资料得知,最初,人们直接用氯气作漂白剂,但使用起来不方便,效果也不理想.经过多年的实验、改进,才有了今天常用的漂白粉.
①你认为“使用起来不方便,效果也不理想”的原因是氯气的溶解度不大,且生成的HClO不稳定,难保存.
②科研人员以氯气、石灰石、水为原料制取漂白粉,有关反应的化学方程式是:CaCO3═CaO+CO2↑,CaO+H2O=Ca(OH)2,2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O.
分析 (1)氯气通入水中生成盐酸和次氯酸;
(2)①实验Ⅰ反应现象说明氯气和水反应生成盐酸具有酸性,可以使蓝色石蕊试纸变红,生成的次氯酸具有强氧化性能漂白有机色素;
②a.向氯水中滴加足量AgNO3溶液,溶液中银离子会和氯离子生成氯化银白色沉淀;
b.氯气和水反应生成氯化氢和次氯酸,其中氯化氢和硝酸银反应生成氯化银沉淀和硝酸,次氯酸是弱酸不能发生反应,据此书写化学方程式;
③实验设计是将少量稀硝酸点在蓝色石蕊试纸上,试纸变红未褪色,验证硝酸无漂白性,实验Ⅱ中反应后的溶液中含有硝酸和次氯酸,都具有氧化性,但次氯酸具有漂白性,可以使变色的试纸褪色;
(3)①直接用氯气作漂白剂,氯气和水反应生成的次氯酸不稳定见光分解,氯气溶解性不大;
②氯气、石灰石、水为原料制取漂白粉,是煅烧石灰石生成氧化钙,氧化钙溶于水生成氢氧化钙,氯气通入氢氧化钙中反应生成氯化钙、次氯酸钙和水;
解答 解:(1)把Cl2通入水中,反应的化学方程式是Cl2+H2O?HCl+HClO,
故答案为:Cl2+H2O?HCl+HClO;
(2)①实验Ⅰ反应现象说明氯气和水反应生成盐酸具有酸性,可以使蓝色石蕊试纸变红,生成的次氯酸具有强氧化性能漂白有机色素,所以试纸先变红后褪色,氯水具有的性质是酸性、强氧化性或漂白性,
故答案为:酸性、强氧化性或漂白性;
②a.向氯水中滴加足量AgNO3溶液,溶液中银离子会和氯离子生成氯化银白色沉淀,Ag++Cl-=AgCl↓,
故答案为:AgCl;
b.氯气和水反应生成氯化氢和次氯酸,其中氯化氢和硝酸银反应生成氯化银沉淀和硝酸,次氯酸是弱酸不能发生反应,据此书写化学方程式;
Cl2+H2O?HCl+HClO,HCl+AgNO3=AgCl↓+HNO3,反应总的化学方程式为:Cl2+H2O+AgNO3?AgCl↓+HClO+HNO3,
故答案为:H2O,HClO;
③实验设计是将少量稀硝酸点在蓝色石蕊试纸上,试纸变红未褪色,验证硝酸无漂白性,实验Ⅱ中反应后的溶液中含有硝酸和次氯酸,都具有氧化性,但次氯酸具有漂白性,可以使变色的试纸褪色,取实验Ⅱ中ⅱ的无色溶液,点在蓝色石蕊试纸上,试纸褪色,证明是次氯酸的漂白性,
故答案为:取实验Ⅱ中ⅱ的无色溶液,点在蓝色石蕊试纸上,试纸褪色;
(3)①直接用氯气作漂白剂,氯气溶解性不大,氯气和水反应生成的次氯酸不稳定见光分解,容易变质不易保存,
故答案为:氯气的溶解度不大,且生成的HClO不稳定,难保存;
②氯气、石灰石、水为原料制取漂白粉,是煅烧石灰石生成氧化钙,反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,氧化钙溶于水生成氢氧化钙,反应的化学方程式为:CaO+H2O=Ca(OH)2,氯气通入氢氧化钙中反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O;
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+H2O=Ca(OH)2,2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O.
点评 本题考查较为综合,主要是氯气及其化合物性质的应用,设计元素化合物知识以及实验设计等问题,题目难度中等,建议在学习中牢固把握相关物质的性质.

| A. | 现象ⅰ、ⅱ说明NaOH溶液能溶解Al2O3 | |
| B. | 现象ⅱ、ⅲ是因为发生了反应:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | 现象ⅰ、ⅱ,可推测家用铝制餐具不宜长时间盛放碱性食物 | |
| D. | 上述实验说明活泼金属都具有类似的性质 |
| A. | NA个Fe(OH)3胶体粒子的质量为107g | |
| B. | 8.0gCu2S和CuO的混合物中含有铜原子数为0.1NA | |
| C. | 标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA | |
| D. | 5.6gFe与0.1mol Cl2完全反应,反应中转移的电子数为0.3NA |
| A. | 二氧化硫可广泛用于食品的漂白 | |
| B. | 从海水提取物质都必须通过化学反应才能实现 | |
| C. | 葡萄糖可用于补钙药物的合成 | |
| D. | “地沟油”禁止食用,也不能用来制肥皂 |
| A. | 杂化轨道全部参加形成化学键 | |
| B. | 在晶体中,只要有阴离子一定有阳离子 | |
| C. | 某固态单质能导电,该单质一定属于金属晶体 | |
| D. | SiO2分子中每个Si原子周围有4个O原子,每个O原子周围有2个Si原子 |
| A. | 使用新能源,减少化石燃料的燃烧,可防止酸雨的产生 | |
| B. | 明矾在水中能形成胶体,可作为净水剂 | |
| C. | 建设三峡大坝使用了大量水泥,水泥是硅酸盐材料 | |
| D. | 给汽车安装尾气转化装置,易产生光化学烟雾 |