题目内容
9.CO2的相对分子质量为44,CO2的摩尔质量为44 g/mol,6.6g CO2的物质的量是0.15 mol,含有0.15NA个CO2分子,含有0.3mol O,体积约为3.36L(标准状况下).分析 二氧化碳的相对分子质量为44;摩尔质量为44 g/mol,根据n=$\frac{m}{M}$进行计算,N=nNA,一分子二氧化碳中含有两个氧原子,V=nVm,由此分析解答.
解答 解:二氧化碳的相对分子质量为44;摩尔质量为44 g/mol,n=$\frac{m}{M}$=$\frac{6.6g}{44g/mol}$=0.15mol,含有二氧化碳的分子数为:N=nNA=0.15NA,一分子二氧化碳中含有两个氧原子,所以含有氧原子的物质的量为:0.3mol,V=nVm=0.15×22.4=3.36L,故答案为:44,44 g/mol,0.15 mol,0.15NA,0.3,3.36L.
点评 本题考查常用化学计量的有关计算,为高频考点,侧重于学生的分析、计算能力的考查,比较基础,注意对公式的理解与运用,注意基础知识的理解掌握.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
20. 已知绿茶中含有EGCG,该物质具有抗癌作用,EGCG的结构简式如图所示,有关说法不正确的是( )
已知绿茶中含有EGCG,该物质具有抗癌作用,EGCG的结构简式如图所示,有关说法不正确的是( )
 已知绿茶中含有EGCG,该物质具有抗癌作用,EGCG的结构简式如图所示,有关说法不正确的是( )
已知绿茶中含有EGCG,该物质具有抗癌作用,EGCG的结构简式如图所示,有关说法不正确的是( )| A. | 1molEGCG最多可与9mol H2发生加成反应 | |
| B. | 1molEGCG最多可与含6mol Br2的浓溴水反应 | |
| C. | EGCG在空气中易被氧化 | |
| D. | EGCG能与碳酸氢钠溶液反应 |
4.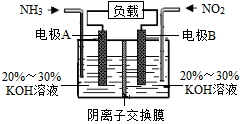 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法正确的是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法正确的是( )
 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法正确的是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示.下列说法正确的是( )| A. | 电极B为负极 | |
| B. | 电极A的反应式为2NH3-6e-+6OH-=N2+6H2O | |
| C. | 溶液中OH-通过阴离子交换膜从左向右迁移 | |
| D. | 当有4.48LNO2(标准状况下)被处理时,转移的电子为0.4mol |
14.下列事实不能用勒夏特列原理解释的是( )
| A. | 将氯化铁溶液加热蒸干最终得不到氯化铁固体 | |
| B. | 锅炉中的水垢中含硫酸钙,可先用碳酸钠溶液处理,再用酸去除 | |
| C. | 实验室可用排饱和食盐水的方法收集氯气 | |
| D. | 钢铁在潮湿的空气中容易生锈 |
1.用NA表示阿伏加德罗常数的值.下列说法中正确的是( )
| A. | 标准状况下,22.4L酒精中含有的分子数目为NA | |
| B. | 常温常压下,l.mol/L盐酸中含有的氯离子数目为NA | |
| C. | 常温常压下,24gO2和24gO3含有的氧原子数目都为1.5NA | |
| D. | 标准状况下,2.24L氯气与足量NaOH溶液反应转移的电子数为0.2NA |
18.下列有关物质的性质或用途的叙述中不正确的是( )
| A. | 碳酸氢钠可用于治疗胃酸过多 | |
| B. | 用氯化钡溶液可鉴别SO42-和CO32- | |
| C. | CO、NO、NO2都是大气污染物 | |
| D. | 常温下,可用铝制或铁制槽车运输浓硫酸 |
19.从下列事实所得出的相应结论正确的是( )
| 实 验 事 实 | 结 论 | |
| ① | 在相同温度下,向1mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 溶解度:Mg(OH)2>Fe(OH)3 |
| ② | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| ③ | 在测定溶液中氯离子含量的时候,使用黄色的铬酸钾(K2CrO4)溶液充当指示剂 | 溶度积常数:铬酸银>氯化银 |
| ④ | 已知乙醇和乙酸都能与金属钠反应放出氢气 | 乙醇和乙酸都是电解质 |
| ⑤ | 测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| A. | ③④⑤ | B. | ②⑤ | C. | ①②③ | D. | 全部 |