题目内容
有以下四种物质:①44g CO2,②5g H2,③1.204×1024氦气(He)④4℃36ml H2O.它们所含分子数最多的是 ,所含原子数最多的是 ,质量最大的是 .(填序号)
考点:物质的量的相关计算
专题:计算题
分析:根据m=ρV计算水的质量,再根据n=
=
计算各物质的物质的量,结合各分子含有原子数目计算原子总物质的量,由N=nNA可知,物质的量越大,含有分子数目越多、原子数目越多,根据m=nM计算氦气的质量,进而比较质量.
| m |
| M |
| N |
| NA |
解答:
解:①44g CO2的物质的量=
=1mol,原子总物质的量=1mol×3=3mol;
②5g H2的物质的量=
=2.5mol,n(H)=2.5mol×2=5mol;
③1.204×1024氦气(He)的物质的量=
=2mol,n(He原子)=2mol,m(He)=2mol×4g/mol=8g;
④4℃36ml H2O的质量=36mL×1g/mL=36,物质的量=
=2mol,含有原子物质的量=2mol×3=6mol,
故所含分子数最多的是②,所含原子数最多的是④,质量最大的是①,
故答案为:②;④;①.
| 44g |
| 44g/mol |
②5g H2的物质的量=
| 5g |
| 2g/mol |
③1.204×1024氦气(He)的物质的量=
| 1.204×1024 |
| 6.02×1023mol-1 |
④4℃36ml H2O的质量=36mL×1g/mL=36,物质的量=
| 36g |
| 18g/mol |
故所含分子数最多的是②,所含原子数最多的是④,质量最大的是①,
故答案为:②;④;①.
点评:本题考查物质的量有关计算,注意对公式的理解与灵活应用,注意稀有气体为单原子分子.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、1mol Na2O2固体中含离子总数为4NA | ||
| B、标准状况下,22.4L己烷中共价键数目为19NA | ||
| C、由乙烯和环己烷组成的混合物28g,含电子数为16NA | ||
D、1L浓度为1mol/L的Na2CO3溶液中含有的
|
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、25℃,1.01×105 Pa,64g SO2中含有的原子数为3NA |
| B、在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| C、含有NA个氩原子的氩气在标准状况下的体积约为11.2L |
| D、标准状况下,11.2L H2O2含有的分子数为0.5NA |
在做中和热实验测定中和热时,应使用的仪器正确的组合是( )
(1)天平 (2)量筒 (3)烧杯 (4)滴定管 (5)温度计 (6)试管 (7)酒精灯.
(1)天平 (2)量筒 (3)烧杯 (4)滴定管 (5)温度计 (6)试管 (7)酒精灯.
| A、(1)(2)(4)(5) |
| B、(2)(3)(5) |
| C、(2)(3)(4)(7) |
| D、全部 |
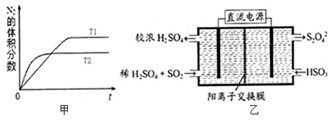 为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要.