题目内容
20.镁及其化合物在生产和生活中有着广泛的应用,依据镁的性质、用途等回答下列问题:已知:①Mg(s)+2H2O(g)═Mg(OH)2(s)+H2(g)△H1=-441kJ•mol-1
②H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H2=+242kJ•mol-1
③Mg(s)+$\frac{1}{2}$O2(g)═MgO(s)△H3=-602kJ•mol-1
则氢氧化镁分解的热化学方程式是Mg(OH)2(s)═MgO(s)+H2O(g)△H=+81kJ•mol-1.
分析 根据盖斯定律将③+②-①得:Mg(OH)2(s)═MgO(s)+H2O(g)△H=△H3+△H2-△H1,据此进行解答.
解答 解:已知:①Mg(s)+2H2O(g)═Mg(OH)2(s)+H2(g)△H1=-441kJ•mol-1
②H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H2=+242kJ•mol-1
③Mg(s)+$\frac{1}{2}$O2(g)═MgO(s)△H3=-602kJ•mol-1.
根据盖斯定律将③+②-①得:Mg(OH)2(s)═MgO(s)+H2O(g)△H=(-602kJ•mol-1)+(+242kJ•mol-1)-(-441kJ•mol-1)=+81 kJ•mol-1,
故答案为:Mg(OH)2(s)═MgO(s)+H2O(g)△H=+81 kJ•mol-1.
点评 本题考查了热化学方程式的书写,题目难度不大,明确盖斯定律的内容为解答关键,注意熟练掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
11.通常实验室制取下述各组气体所用气体发生装置相同的是( )
| A. | H2、O2 | B. | O2、HCl | C. | Cl2、HCl | D. | Cl2、CO2 |
8.涂改液是一种使用率较高的工具,实验证明涂改液含有苯的同系物和卤代烃.下列说法中不正确的是( )
| A. | 涂改液危害人体健康、污染环境 | |
| B. | 中学生最好不用或慎用涂改液 | |
| C. | 苯的同系物和卤代烃皆可溶于水 | |
| D. | 苯的同系物和卤代烃是涂改液中的溶剂 |
15.下列说法正确的是( )
| A. | 甲烷与氯气的混合气体在光照下反应,生成的是一氯甲烷与氯化氢 | |
| B. | 向盛有乙醇的烧杯中投入一小块金属钠,可以观察到钠块沉在乙醇液面下面 | |
| C. | 氯仿能发生水解反应和消去反应 | |
| D. | 乙烯可作水果催熟剂,无水乙醇直接用作医疗消毒剂 |
5.密闭容器中可逆反应2NO2(g)?N2O4(g)+Q(Q>0)达到平衡后,若增大压强,下列说法不正确的是( )
| A. | 混合气体颜色变浅 | B. | 逆反应速率加快 | ||
| C. | NO2转化率增大 | D. | 气体平均分子量变大 |
12.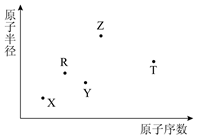 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡.下列说法正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡.下列说法正确的是( )
 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡.下列说法正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.Y与Z能形成Z2Y、Z2Y2型离子化合物,R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡.下列说法正确的是( )| A. | 最高价氧化物对应水化物的酸性R>T | |
| B. | 氢化物的沸点一定是Y>R | |
| C. | 原子半径和离子半径均满足Y<Z | |
| D. | 由X、Y、Z、T四种元素组成的化合物中既含有离子键又含有共价键 |
2.已知:A(g)+2B(g)?C(g)+D(g)△H<0,一定温度下,2molA和2molB在2L密闭容器中反应,10min后达到平衡,此时容器压强降为原来的$\frac{4}{5}$,下列叙述正确的是( )
| A. | 从开始到平衡,A的反应速率为0.08mol•L-1•min-1 | |
| B. | 随着反应的进行,混合气体的密度逐渐减小 | |
| C. | 达到平衡时,B的转化率为20% | |
| D. | 该温度下,反应的平衡常数K=$\frac{20}{3}$ |
3.医学上由于肾功能衰竭会引起血液中毒,需进行净化排毒,常用的血液净化方法与下列过程相似的是( )
| A. | 聚沉 | B. | 电泳 | C. | 渗析 | D. | 过滤 |