题目内容
下列说法正确的是( )
| A、水泥、玻璃、青花瓷、水晶、玛瑙、分子筛都属于硅酸盐工业产品 |
| B、二氧化碳通入水玻璃可以得到原硅酸 |
| C、因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸比碳酸强 |
| D、2MgO?SiO2中的酸根阴离子为SiO42- |
考点:含硫物质的性质及综合应用,硅和二氧化硅
专题:碳族元素
分析:A、水晶、玛瑙的主要成分是二氧化硅;
B、碳酸酸性大于硅酸;
C、因为高温时二氧化硅与碳酸钠反应放出二氧化碳,利用的是难挥发性酸酐制备易挥发性酸酐,碳酸酸性大于硅酸;
D、硅酸盐可以写成氧化物形式,依据元素化合价分析判断;
B、碳酸酸性大于硅酸;
C、因为高温时二氧化硅与碳酸钠反应放出二氧化碳,利用的是难挥发性酸酐制备易挥发性酸酐,碳酸酸性大于硅酸;
D、硅酸盐可以写成氧化物形式,依据元素化合价分析判断;
解答:
解:A、水晶、玛瑙的主要成分是二氧化硅,水泥、玻璃、青花瓷、分子筛都属于硅酸盐工业产品,故A错误;
B、二氧化碳通入水玻璃可以得到原硅酸,故B正确;
C、因为高温时二氧化硅与碳酸钠反应放出二氧化碳,利用的是难挥发性酸酐制备易挥发性酸酐,碳酸酸性大于硅酸,故C错误;
D、硅酸盐可以写成氧化物形式,2MgO?SiO2中写成盐为Mg2SiO4,2MgO?SiO2中的酸根阴离子为SiO44-,故D错误;
故选B.
B、二氧化碳通入水玻璃可以得到原硅酸,故B正确;
C、因为高温时二氧化硅与碳酸钠反应放出二氧化碳,利用的是难挥发性酸酐制备易挥发性酸酐,碳酸酸性大于硅酸,故C错误;
D、硅酸盐可以写成氧化物形式,2MgO?SiO2中写成盐为Mg2SiO4,2MgO?SiO2中的酸根阴离子为SiO44-,故D错误;
故选B.
点评:本题考查了物质组成和结构分析判断,物质性质的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
一位学生在做乙醛的还原性实验时,取1mol?L-1 CuSO4 溶液和0.5mol?L-1 NaOH 溶液各1mL,在一支试管中混合后又加入0.5mL 40%乙醛溶液,结果无红色沉淀产生.实验失败的原因可能是( )
| A、加入的NaOH 不够 |
| B、加入的CuSO4 不够 |
| C、未用水浴加热 |
| D、加入的乙醛太少 |
在某无色透明的溶液中,能共存的离子组是( )
| A、Na+、H+、SO42-、HCO3- |
| B、MnO4-、Na+、S2-、K+ |
| C、Na+、K+、Cl-、NO3- |
| D、Fe3+、K+、SO42-、Cl- |
pH=2的强酸溶液,加水稀释,若溶液体积扩大10倍,则C(H+)或C(OH-)的变化( )
| A、c(H+)和c(OH-)都减少 |
| B、c(H+)增大 |
| C、c(OH-)减小 |
| D、c(H+)减小 |
下列装置中电流表指针会发生偏转的是( )
A、 |
B、 |
C、 |
D、 |
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如图所示.Z元素原子核外K层与M层电子数相等.下列说法中正确的是( )
| X | Y | ||
| Z | W |
| A、原子半径由小到大的顺序为:Y<X<W<Z |
B、X元素最高价氧化物分子的比例模型为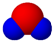 |
| C、Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性 |
| D、W的单质在地壳含量丰富,是国家经济发展的重要基础原材料.2005年美国科学家发现了W的“超级原子”结构-W13 |
下列有关金属腐蚀与防护的说法正确的是( )
| A、可将地下输油管与外加直流电源的正极相连以保护它不受腐蚀 |
| B、当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C、在海轮外壳连接一锌块保护外壳不受腐蚀是采用了牺牲阴极的阳极保护法 |
| D、纯银器表面在空气中因化学腐蚀渐渐变暗 |
 如图是一定条件下N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )
如图是一定条件下N2与H2反应过程中能量变化的曲线图.下列叙述正确的是( )| A、该反应的热化学方程式为:N2+3H2?2NH3△H=-92kJ?mol-1 |
| B、a曲线是加入催化剂时的能量变化曲线 |
| C、加入催化剂,该化学反应的反应热不变 |
| D、在相同温度的条件下,在体积相同I、II两个容器中分别通入1mol N2和3 mol H2,容器I体积恒定,容器II体积可变保持恒压,则反应过程中两容器内的反应速率v(I)<v(II) |