题目内容
9.有关物质的转化关系如图所示(部分物质和条件已略去).A、C、E、G是中学化学中的常见单质,A为黑色粉末,G为黄绿色气体,E在G 中燃烧时发出苍白色火焰,F的焰色反应显黄色,B是常见的无色液体,K为红褐色沉淀.
请回答下列问题:
(1)G的化学式为Cl2,F的化学式为NaOH
(2)D、B、H混和生成J和I的离子方程式:Fe3O4+8H+═Fe2++2Fe3++4H2O
(3)常温下G与F的溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O
(4)J转变为I的化学方程式:2FeCl2+Cl2═2FeCl3.
分析 A、C、E、G是中学化学中的常见单质,其中G呈黄绿色,则G为Cl2,E在G中燃烧发生苍白色火焰,则E为H2,反应生成H为HCl,B是常见的无色液体,则B为水,K为红褐色沉淀,则K为Fe(OH)3;
根据图中各物质转化关系,A单质与水高温生成氢气和D,D和H的水溶液即盐酸反应生成J和I,J与氯气反应生成I,I与A反应生成J,可推知,A为Fe,D为Fe3O4,J为FeCl2,I为FeCl3,B和单质C反应生成F和氢气,F的焰色反应显黄色,则C为Na,F为NaOH,F与氯化铁生成氢氧化铁,符合转化关系.
解答 解:A、C、E、G是中学化学中的常见单质,其中G呈黄绿色,则G为Cl2,E在G中燃烧发生苍白色火焰,则E为H2,反应生成H为HCl,B是常见的无色液体,则B为水,K为红褐色沉淀,则K为Fe(OH)3;
根据图中各物质转化关系,A单质与水高温生成氢气和D,D和H的水溶液即盐酸反应生成J和I,J与氯气反应生成I,I与A反应生成J,可推知,A为Fe,D为Fe3O4,J为FeCl2,I为FeCl3,B和单质C反应生成F和氢气,F的焰色反应显黄色,则C为Na,F为NaOH,F与氯化铁生成氢氧化铁,
(1)通过以上分析知,G是Cl2、F是NaOH,故答案为:Cl2;NaOH;
(2)四氧化三铁和酸反应生成亚铁离子、铁离子和水,离子方程式为Fe3O4+8H+═Fe2++2Fe3++4H2O,故答案为:Fe3O4+8H+═Fe2++2Fe3++4H2O;
(3)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O
,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯气具有强氧化性,氯化亚铁具有还原性,二者发生氧化还原反应,所以氯化亚铁和氯气反应生成氯化铁,反应方程式为2FeCl2+Cl2═2FeCl3.,故答案为:2FeCl2+Cl2═2FeCl3.
点评 本题易铁及其化合物之间的转化为载体考查无机物推断,为高频考点,明确常见物质特殊颜色、特殊性质及物质之间的转化是解本题关键,注意题干中的关键词,题目难度不大.

| A. | 用FeCl溶液腐蚀印刷电路板Fe3++Cu═Fe2++Cu2+ | |
| B. | 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O | |
| C. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| A. | 只有Fe2+ | B. | Na+、Fe3+ | ||
| C. | Na+、Fe3+ 和H+ | D. | H+、Na+、Fe3+ 和Fe2+ |

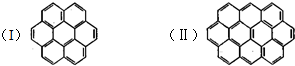 有两个或两个以上的苯环以共有环边的方式相互稠合的多环芳香烃称为稠环芳香烃.下图中椭圆烯也属于稠环芳香烃.据此回答:
有两个或两个以上的苯环以共有环边的方式相互稠合的多环芳香烃称为稠环芳香烃.下图中椭圆烯也属于稠环芳香烃.据此回答: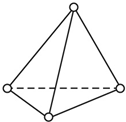 (1)根据要求填空:
(1)根据要求填空:
 硫化亚铁是一种黑色块状固体,常温下难溶于水,易溶于酸而生成能溶于水的硫化氢气体.硫化亚铁在空气中煅烧时生成二氧化硫气体和烧渣.
硫化亚铁是一种黑色块状固体,常温下难溶于水,易溶于酸而生成能溶于水的硫化氢气体.硫化亚铁在空气中煅烧时生成二氧化硫气体和烧渣.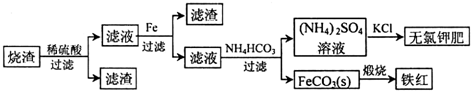
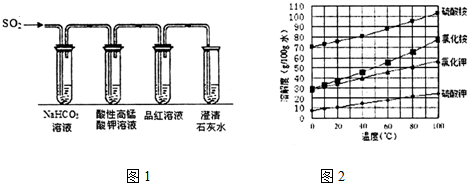
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种化合价,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题: