题目内容
19.下列离子方程式书写正确的是( )| A. | 用FeCl溶液腐蚀印刷电路板Fe3++Cu═Fe2++Cu2+ | |
| B. | 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O | |
| C. | 钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
分析 A.转移电子不守恒、电荷不守恒;
B.二者反应生成碳酸钙和水;
C.转移电子不守恒、电荷不守恒;
D.一水合氨是弱电解质,应该写化学式.
解答 解:A.转移电子不守恒、电荷不守恒,离子方程式为2Fe3++Cu═2Fe2++Cu2+,故A错误;
B.二者反应生成碳酸钙和水,离子方程式为CO2+Ca2++2OH-═CaCO3↓+H2O,故B正确;
C.转移电子不守恒、电荷不守恒,离子方程式为2Na+2H2O═2Na++2OH-+H2↑,故C错误;
D.一水合氨是弱电解质,应该写化学式,离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故D错误;
故选B.
点评 本题考查离子方程式正误判断,明确反应实质及物质性质是解本题关键,注意要遵循原子守恒、电荷守恒及转移电子守恒,注意B中如果是澄清石灰水要写离子,如果是石灰乳要写化学式,且该反应还与反应物的量有关,题目难度不大.

练习册系列答案
相关题目
9.下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),反应结果并不改变的是( )
| A. | Na和O2 | B. | Cu和硝酸 | C. | Cu和硫酸 | D. | Al和NaOH |
10.下列有关工业合成氨的说法不能用平衡移动原理解释的是( )
| A. | 不断补充氮气和氢气 | |
| B. | 选择20MPa-50MPa的高压 | |
| C. | 及时液化分离氨气 | |
| D. | 选择500℃左右的高温同时使用铁触媒做催化剂 |
14.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,1molCH4分子中含有8NA个电子 | |
| B. | 常温常压下,11.2LO3中含有0.5NA个O3分子 | |
| C. | 0.1mol/LNa2SO4溶液中含Na+的数目为0.2NA | |
| D. | Na2O2与水反应产生1molO2时,转移2NA个电子 |
4.X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,W、Y为金属元素,X 原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体.W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等. 下列说法正确的是( )
| A. | 气态氢化物的稳定性:X<Z | |
| B. | 原子半径:W>Y>Z>X | |
| C. | 最高价氧化物对应水化物的碱性:Y>W | |
| D. | Y、Z的氧化物都有酸性和碱性 |
 合理使用药物是保证身心健康、提高生活质量的有效手段.药物化学已经成为化学的一个重要领域.
合理使用药物是保证身心健康、提高生活质量的有效手段.药物化学已经成为化学的一个重要领域.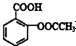 是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为: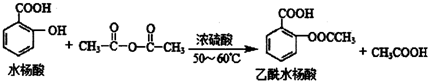
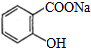 .
.