题目内容
6.下列物质中属于离子化合物的是( )| A. | H2 | B. | CH3COOH | C. | HCl | D. | (NH4)2SO4 |
分析 一般来说,活泼金属与非金属形成离子键,含离子键的化合物一定为离子化合物,以此来解答.
解答 解:A.为含H-H共价键的单质,故A不选;
B.含共价键的共价化合物,故B不选;
C.只含H-Cl共价键,为共价化合物,故C不选;
D.含铵根离子与硫酸根离子之间的离子键,为离子化合物,故D选;
故选D.
点评 本题考查化学键及物质分类,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
14.下列7种物质中,既能使酸性高锰酸钾溶液褪色,又能使溴的四氯化碳溶液褪色的是( )
①甲苯 ②苯 ③聚乙烯 ④2-丁炔 ⑤环己烷 ⑥1,3-丁二烯 ⑦SO2 .
①甲苯 ②苯 ③聚乙烯 ④2-丁炔 ⑤环己烷 ⑥1,3-丁二烯 ⑦SO2 .
| A. | ③④⑤⑥⑦ | B. | ③④⑥ | C. | ④⑥⑦ | D. | ①③④⑤ |
1.提出元素周期律并根据周期律编制第一个元素周期表的科学家是( )
| A. | 道尔顿 | B. | 拉瓦锡 | C. | 门捷列夫 | D. | 阿伏加德罗 |
11.用FeCl3酸性溶液脱除 H2S后的废液,通过控制电压电解得以再生.某同学使用石墨电极,在不同电压(x)下电解 pH=1 的 0.1mol/L FeCl2溶液,研究废液再生机理.记录如下(a、b、c代表电压值:)
(1)用 FeCl3酸性溶液脱除 H2S的离子方程式为2Fe3++H2S=2Fe2++2H++S↓.
(2)Ⅰ中,Fe3+产生的原因可能是 Cl- 在阳极放电,生成的 Cl2将 Fe2+氧化.写出有关反
应的方程式和电极反应式Cl2+2Fe2+=2Fe3++2Cl-;2Cl--2e-=Cl2↑.
(3)由Ⅱ推测,Fe3+产生的原因还可能是 Fe2+在阳极放电,电极反应式为Fe2+-e-=Fe3+.
(4)Ⅱ中虽未检测出 Cl2,但 Cl- 在阳极是否放电仍需进一步验证.电解 pH=1 的 NaCl溶液做对照实验,记录如下:
①NaCl溶液的浓度是0.2mol/L.
②与Ⅱ对比,可得出的结论:ABC
A.通过控制电压,验证了 Fe2+先于 Cl- 放 电
B.电压过小,Cl- 可 能 不 放 电
C. 通过控制电压,证实了产生 Fe3+的两种原因都成立
D. 通过控制电压,证实了产生 Fe3+一定仅是由于生成的 Cl2将 Fe2+氧化.
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| I | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| II | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| III | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(2)Ⅰ中,Fe3+产生的原因可能是 Cl- 在阳极放电,生成的 Cl2将 Fe2+氧化.写出有关反
应的方程式和电极反应式Cl2+2Fe2+=2Fe3++2Cl-;2Cl--2e-=Cl2↑.
(3)由Ⅱ推测,Fe3+产生的原因还可能是 Fe2+在阳极放电,电极反应式为Fe2+-e-=Fe3+.
(4)Ⅱ中虽未检测出 Cl2,但 Cl- 在阳极是否放电仍需进一步验证.电解 pH=1 的 NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
②与Ⅱ对比,可得出的结论:ABC
A.通过控制电压,验证了 Fe2+先于 Cl- 放 电
B.电压过小,Cl- 可 能 不 放 电
C. 通过控制电压,证实了产生 Fe3+的两种原因都成立
D. 通过控制电压,证实了产生 Fe3+一定仅是由于生成的 Cl2将 Fe2+氧化.
18.在一定温度下将amol PCl5充入一密闭容器中达到如下平衡:PCl5(g)?PCl3(g)+Cl2(g),此时压强为P1;再向容器中通入amol PCl5,在同温下又达到平衡时的压强为P2,则下列说法中正确的是( )
| A. | 2P1>P2 | B. | 2P1=P2 | C. | 2P1<P2 | D. | P1>P2 |
16.某学生的实验报告所列出的下列数据中合理的是( )
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用酸式滴定管量取25.00ml稀硫酸 | |
| C. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| D. | 用托盘天平称量15.42gNaCl固体 |
 ;
; ;
;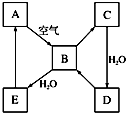 如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.
如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.