题目内容
2.下列有关化学键与晶体结构说法正确的是( )| A. | 两种元素组成的分子中所含化学键一定都是极性键 | |
| B. | 金属晶体的熔点一定比分子晶体的高 | |
| C. | 某晶体中含有阳离子,则一定也含有阴离子 | |
| D. | 含有阴离子的化合物一定含有阳离子 |
分析 A.两种元素组成的分子中可能含非极性键;
B.一般金属晶体的熔点比分子晶体的高;
C.金属晶体中含金属阳离子和自由电子;
D.含阴离子的化合物一定为离子化合物.
解答 解:A.两种元素组成的分子中可能含非极性键,如H-O-O-H含极性键和非极性键,故A错误;
B.一般金属晶体的熔点比分子晶体的高,如常温下Hg的熔点低于碘,故B错误;
C.金属晶体中含金属阳离子和自由电子,则不一定含阴离子,故C错误;
D.含阴离子的化合物一定为离子化合物,则一定含阳离子,故D正确;
故选D.
点评 本题考查物质中的化学键,为高频考点,把握化学键的形成及化学键判断的一般规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
13.现有下列十种物质:①NH3 ②铁 ③Ba(OH)2 ④CO2 ⑤H2SO4 ⑥NaOH ⑦红褐色的氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
(2)上述十种物质中有两种物质之间可发生离子反应,H++OH-=H2O,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O(写一个).
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++2SO42-,17.1g⑩溶于水配成250mL溶液,SO42-的物质的量浓度为0.6mol/L.
(4)少量的④通入⑥的溶液中反应的离子方程式为CO2+2OH-=CO32-+H2O.
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 单质 | 氧化物 | 混合物 | 胶体 | 电解质 | 非电解质 |
| 属于该类的物质 | ② | ④ | ⑧⑨ | ⑦ | ③⑤⑥ | ①④ |
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++2SO42-,17.1g⑩溶于水配成250mL溶液,SO42-的物质的量浓度为0.6mol/L.
(4)少量的④通入⑥的溶液中反应的离子方程式为CO2+2OH-=CO32-+H2O.
10.下列关于钠的叙述正确的是( )
| A. | 将4.6 g金属钠放入95.4 g蒸馏水中,可得到溶质质量分数为8%的溶液 | |
| B. | 金属钠与水的反应实质上是与水电离产生的H+反应 | |
| C. | 将金属钠投入饱和NaCl溶液中,会有晶体析出,钠的性质活泼,故应保存在CCl4中 | |
| D. | 做有关钠的性质实验时,剩余的Na不用放回原试剂瓶 |
17.已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验:设第3步所得固体D的质量为 32g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L,则X中FeO与CuO的物质的 量之比为( )


| A. | 4:1 | B. | 1:2 | C. | 2:1 | D. | 1:1 |
7.某研究性学习小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查):

(1)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是排除装置中氧气对实验的干扰.
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中.向第1支试管中滴加适量氨水出现白色沉淀BaSO3(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有氧化 性.
(5)装置D的作用是吸收SO2尾气,防止污染空气.
(6)实验后,测定装置D中溶液呈碱性.溶液为什么呈碱性呢?大家有两种不同的假设:①是生成的Na2SO3水解;②是氢氧化钠剩余.请设计实验方案证明哪种假设成立.可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
(7)另一小组利用装置E进行实验:SO2性质实验之后,用注射器对实验室内空气进行取样.并向装置E中共注入V mL(已折算为标况下体积)的空气,当溶液刚好褪色时,停止实验.请计算该空气中SO2的体积分数(用含V的代数式表示)$\frac{2.8}{V}$.

(1)装置A中反应的化学方程式是Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是排除装置中氧气对实验的干扰.
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中.向第1支试管中滴加适量氨水出现白色沉淀BaSO3(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-.
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有氧化 性.
(5)装置D的作用是吸收SO2尾气,防止污染空气.
(6)实验后,测定装置D中溶液呈碱性.溶液为什么呈碱性呢?大家有两种不同的假设:①是生成的Na2SO3水解;②是氢氧化钠剩余.请设计实验方案证明哪种假设成立.可任选下列试剂进行实验:Na2SO3溶液、酚酞溶液、氯水、BaCl2溶液、稀硫酸
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 1 | 取少量溶液于试管中,滴入几滴酚酞 | 溶液变红 |
| 2 |
11.X、Y、Z三种强电解质,它们在水中电离出的离子如下表所示:
如图1所示装置中,甲、乙、丙三个烧杯依次分别盛放250mL足量的X溶液、足量的Y溶液、足量的Z溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加6.4g.常温下各烧杯中溶液的pH与电解时间t的关系图2如下.据此回答下列问题:
(1)M为电源的负极(填写“正”或“负”).电解一段时间后,在e、f两极附近分别滴加酚酞,变红的是e极.
(2)甲烧杯中电极b上发生的电极反应为4OH--4e-=O2↑+2H2O.
(3)乙烧杯电解的总反应离子方程式为2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+;甲烧杯中a、b两极共产生标准状况下3.36L的气体.

如图1所示装置中,甲、乙、丙三个烧杯依次分别盛放250mL足量的X溶液、足量的Y溶液、足量的Z溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加6.4g.常温下各烧杯中溶液的pH与电解时间t的关系图2如下.据此回答下列问题:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
(2)甲烧杯中电极b上发生的电极反应为4OH--4e-=O2↑+2H2O.
(3)乙烧杯电解的总反应离子方程式为2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+;甲烧杯中a、b两极共产生标准状况下3.36L的气体.

 尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题:
尿素[H2NCONH2]既是一种非常重要的高氮化肥,又是多种有机、无机产品的生产原料.工业上以合成氨厂的NH3和CO2为原料生产尿素.请回答下列问题: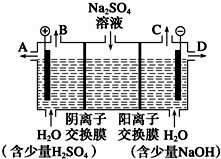 天然矿物芒硝化学式为Na2SO4•10H2O,为无色晶体,易溶于水.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
天然矿物芒硝化学式为Na2SO4•10H2O,为无色晶体,易溶于水.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.