题目内容
使反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol.此反应的平均速率v(X)为( )
| A、v (NH3)=0.05mol?L-1?s-1 |
| B、v(O2)=0.015mol?L-1.s-1 |
| C、v(N2)=0.02mol?L-1?s-1 |
| D、v(H2O)=0.02mol?L-1?S-1 |
考点:化学反应速率和化学计量数的关系
专题:化学反应速率专题
分析:根据v=
计算v(N2),再根据不同物质表示的速率之比等于其化学计量数之比计算.
| ||
| △t |
解答:
解:在2L的密闭容器中进行,半分钟后N2的物质的量增加了0.6mol,则v(N2)=
=0.01mol/(L.s),
A.v (NH3)=2v(N2)=0.02mol/(L.s),故A错误;
B.v (O2)=
v(N2)=
×0.01mol/(L.s)=0.015mol/(L.s),故B正确;
C.由上述计算可知,v(N2)=0.01mol/(L.s),故C错误;
D.v (H2O)=3v(N2)=0.03mol/(L.s),故D错误,
故选B.
| ||
| 30s |
A.v (NH3)=2v(N2)=0.02mol/(L.s),故A错误;
B.v (O2)=
| 3 |
| 2 |
| 3 |
| 2 |
C.由上述计算可知,v(N2)=0.01mol/(L.s),故C错误;
D.v (H2O)=3v(N2)=0.03mol/(L.s),故D错误,
故选B.
点评:本题考查化学反应速率的有关计算,比较基础,常用计算方法有定义法与化学计量数法,注意根据情况选择合适的计算方法.

练习册系列答案
相关题目
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只能被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A、原混合液中NO3-的物质的量为0.2mol |
| B、OA段产生是NO,AB段反应为2Fe3++Fe=3Fe2+,BC段产生氢气 |
| C、溶液中最终溶质为FeSO4 |
| D、c(H2SO4)为5mol?L-1 |
下列说法中,正确的是( )
| A、CH4是一种很稳定的化合物,这是由于分子内的氢键所致 |
| B、虽然金属原子在三维空间的堆积有多种方式但其空间的利用率星相同的 |
| C、晶体CH4、SiH4、GeH4、SnH4的溶点是依次升高的 |
| D、使用催化剂不会改变反应的限度但能够改变反应焓变和熵变 |
下列离子方程式正确的是( )
| A、0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O | ||||
| B、100ml 0.1mol/L FeI2溶液与标况下0.224L Cl2:2Fe2++Cl2═2Fe3++2Cl- | ||||
C、NH4HCO3溶液与过量NaOH溶液共热:NH4++OH-
| ||||
D、浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+
|
加热蒸干下列物质的溶液并灼烧,可以得到该物质固体的是( )
| A、硫酸铝 | B、碳酸氢钠 |
| C、硫化铵 | D、氯化铝 |
具有相同电子层数的X、Y、Z三种元素,已知它们最高价氧化物对应水化物酸性由强到弱的顺序是HXO4、H2YO4、H3ZO4,则下列判断不正确的是( )
| A、X、Y、Z三种元素在周期表中的位置依次是ⅦA、ⅥA、ⅤA |
| B、原子半径X>Y>Z |
| C、元素原子的得电子能力X>Y>Z |
| D、气态氢化物的化学式依次是HX、H2Y、ZH3 |
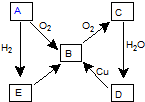 图表示某气态单质A及其化合物之间的转化关系 (某些产物和反应条件已略去).
图表示某气态单质A及其化合物之间的转化关系 (某些产物和反应条件已略去).