题目内容
关于0.2mol?L-1的NaOH溶液,下列说法不正确的是( )
| A、100 mL该溶液中含0.8 g NaOH |
| B、200 mL该溶液与100 mL 0.2 mol?L-1的硫酸溶液反应形成中性溶液 |
| C、100 mL该溶液中约含0.02×6.02×1023个Na+ |
| D、配制含1 L水的该溶液,需NaOH的质量为8 g |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:A.根据n=cV计算NaOH物质的量,再根据m=nM计算其质量;
B.根据n=cV计算NaOH、硫酸的物质的量,结合方程式2NaOH+H2SO4=Na2SO4+2H2O判断;
C.根据n=cV计算Na+物质的量,再根据N=nNA计算;
D.1L 0.2mol/L的NaOH溶液需要NaOH为8g,溶液体积为1L,不是溶剂水的体积.
B.根据n=cV计算NaOH、硫酸的物质的量,结合方程式2NaOH+H2SO4=Na2SO4+2H2O判断;
C.根据n=cV计算Na+物质的量,再根据N=nNA计算;
D.1L 0.2mol/L的NaOH溶液需要NaOH为8g,溶液体积为1L,不是溶剂水的体积.
解答:
解:A.NaOH物质的量=0.1L×0.2mol/L=0.02mol,其质量=0.02mol×40g/mol=0.8g,故A正确;
B.NaOH物质的量=0.2L×0.2mol/L=0.04mol,硫酸的物质的量=0.1L×0.2mol/L=0.02mol,由方程式2NaOH+H2SO4=Na2SO4+2H2O,可知二者恰好反应,所得溶液为硫酸钠溶液,溶液呈中性,故B正确;
C.Na+物质的量=0.1L×0.2mol/L=0.02mol,约含0.02mol×6.02×1023mol-1个Na+,故C正确;
D.1L 0.2mol/L的NaOH溶液需要NaOH为8g,溶液体积为1L,不是溶剂水的体积,故D错误,
故选D.
B.NaOH物质的量=0.2L×0.2mol/L=0.04mol,硫酸的物质的量=0.1L×0.2mol/L=0.02mol,由方程式2NaOH+H2SO4=Na2SO4+2H2O,可知二者恰好反应,所得溶液为硫酸钠溶液,溶液呈中性,故B正确;
C.Na+物质的量=0.1L×0.2mol/L=0.02mol,约含0.02mol×6.02×1023mol-1个Na+,故C正确;
D.1L 0.2mol/L的NaOH溶液需要NaOH为8g,溶液体积为1L,不是溶剂水的体积,故D错误,
故选D.
点评:本题考查物质的量浓度,比较基础,注意对概念的理解与公式的灵活应用.

练习册系列答案
相关题目
下列物质在空气中,久置若变质,在变质过程中,既有氧化还原反应,又有非氧化还原反应发生的是( )
| A、食盐 | B、漂白粉 | C、氯水 | D、胆矾 |
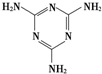 (双项)三聚氰胺(结构式如图所示)是一种重要的化工原料,可用于阻燃剂、水泥减水剂和高分子合成等领域.一些不法分子却往牛奶中加入三聚氰胺,以提高奶制品的含氮量.下列说法正确的是( )
(双项)三聚氰胺(结构式如图所示)是一种重要的化工原料,可用于阻燃剂、水泥减水剂和高分子合成等领域.一些不法分子却往牛奶中加入三聚氰胺,以提高奶制品的含氮量.下列说法正确的是( )| A、三聚氰胺不属于蛋白质 |
| B、三聚氰胺是高分子化合物 |
| C、三聚氰胺分子中含有碳碳双键 |
| D、三聚氰胺的分子式为C3H6N6 |
下列叙述中正确的是( )
| A、同主族金属元素的原子半径越大熔点越高 |
| B、稀有气体原子序数越大沸点越低 |
| C、分子间作用力越弱的分子其沸点越低 |
| D、同周期元素的原子半径越小越易失去电子 |
下列离子方程式正确的是( )
| A、醋酸铵和盐酸反应 CH3COONH4+H+═CH3COOH+NH4+ |
| B、氢氧化钡溶液和硫酸铜溶液反应 Ba2++SO42-═BaSO4↓ |
| C、钠与水反应 Na+2H2O═Na++OH-+H2↑ |
| D、碳酸氢钠溶液与NaOH溶液反应:HCO3-+OH-=CO32-+H2O |
下列有关溶液的说法中,正确的是( )
| A、含H+的溶液显酸性,含OH-的溶液显碱性 |
| B、用丁达尔现象实验可区分葡萄糖溶液和氢氧化铁胶体 |
| C、某饱和溶液变成不饱和溶液,溶质的质量分数一定减小 |
| D、向含有BaCl2和NaOH的混合液中通入足量的二氧化硫,最终会有白色沉淀生成 |
下列事实能说明Al的金属活动性比Cu强的是( )
| A、常温下将铝和铜用导线连接组成原电池放入到氢氧化钠溶液中 |
| B、常温下将铝和铜用导线连接组成原电池放入到稀盐酸溶液中 |
| C、与氯气反应时,铝失去3个电子,而铜失去2个电子 |
| D、Al(OH)3有两性而Cu(OH)2只有弱碱性 |
高温下,将SiO2加入下列物质的熔融体中,此时发生反应能放出气体的是( )
| A、CaO |
| B、Al2O3 |
| C、NaOH |
| D、Na2CO3 |
足量的MnO2与33.3mL 12mol/L浓盐酸反应,同0.1mol MnO2与足量的浓盐酸反应产生的氯气两者相比( )
| A、前者多 | B、后者多 |
| C、一样多 | D、无法确定 |