题目内容
20.如图表示从固体混合物中分离X的2种方案,请回答有关问题.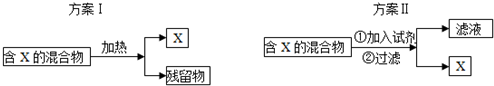
(1)选用方案I时,X应该具有的性质是易升华,残留物应该具有的性质是具有热稳定性(或受热难分解或耐高温等);
(2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是稀硝酸,有关反应的化学方程式为3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O、3Ag+4HNO3(稀)═3AgNO3+NO↑+2H2O;
(3)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),参照方案I和Ⅱ,有3个小组的同学分别设计了以下3个方案,请你选择最合适的实验方案(填序号)B.
A.Fe2O3样品$→_{②过滤}^{①盐酸溶液}$ Fe2O3
B.Fe2O3样品$→_{②过滤}^{①氢氧化钠溶液}$ Fe2O3
C.Fe2O3样品$→_{②过滤}^{①硝酸溶液}$ Fe2O3.
分析 (1)由实验方案可知,用加热的方法分离,则其中一种物质易升华;
(2)方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,金属银和金属铜可以和硝酸反应,但硝酸和金却不反应;
(3)某Fe2O3样品(主要杂质有SiO2、A12O3),只有氧化铁与NaOH溶液不反应,利用足量NaOH溶液,反应后过滤即可.
解答 解:(1)由实验方案可知,用加热的方法分离,则其中一种物质易升华,选用方案I时,X应该具有的性质是易升华,残留物应该具有的性质是具有热稳定性(或受热难分解或耐高温等),
故答案为:易升华;具有热稳定性(或受热难分解或耐高温等);
(2)方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,金属银和金属铜可以和硝酸反应,但硝酸和金却不反应,则加入的试剂是稀硝酸,发生的反应为3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O、3Ag+4HNO3(稀)═3AgNO3+NO↑+2H2O,
故答案为:稀硝酸;3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O、3Ag+4HNO3(稀)═3AgNO3+NO↑+2H2O;
(3)方案A、C中氧化铁均与酸反应,只有方案B中氧化铁与NaOH溶液不反应,利用足量NaOH溶液,反应后过滤得到Fe2O3,即最合适的实验方案为B,
故答案为:B.
点评 本题考查混合物分离提纯及化学实验方案的评价,为高频考点,把握物质的性质、分离流程中发生的反应为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
10.1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,此反应的热化学方程式为( )
| A. | C+H2O═CO+H2 △H=+131.3 kJ•mol-1 | |
| B. | C(s)+H2O(g)═CO(g)+H2(g)△H=+10.94 kJ•mol-1 | |
| C. | C(s)+H2O(l)═CO(g)+H2(g)△H=+131.3 kJ•mol-1 | |
| D. | C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3 kJ•mol-1 |
11.在0.1mol/L NH4NO3溶液中,离子浓度最大的是( )
| A. | NO3- | B. | NH4+ | C. | H+ | D. | OH- |
5.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 15g甲基(-CH3)所含有的电子数是10 NA个 | |
| B. | 1mol苯乙烯中含有的碳碳双键数为4NA个 | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 | |
| D. | 4.2g C3H6中含有的碳碳双键数一定为0.1N |
12.下列化学式或分子式只代表一种物质的是 ( )
| A. | C | B. | CH2Cl2 | C. | C4H10 | D. | C3H7Br |
9.下列各组离子在溶液中可以大量共存的是( )
| A. | H+、NH4+、CO32- | B. | Fe3+、Cl-、NO3- | C. | Na+、OH-、HCO3- | D. | Al3+、OH-、NO3- |
10.下列说法正确的是( )
| A. | 氢气、石油、煤、油脂都属于化石燃料 | |
| B. | 蔗糖及其水解产物均可发生银镜反应 | |
| C. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构体 | |
| D. | 油脂在碱性条件下的水解反应又称为皂化反应 |
 某无色透明的溶液中可能含有K+、NH4+、Mg2+、Al3+、Fe3+、Cl-、SO42-、CO32- 等离子,在此溶液中加入氢氧化钠溶液并加热,结果发现没有气体生成.但有白色沉淀产生.加入的氢氧化钠溶液体积(V)和产生的沉淀量m的关系如图所示.则溶液中一定存在的离子是Mg2+、Al3+,一定不存在的离子是NH4+、Fe3+、CO32-.
某无色透明的溶液中可能含有K+、NH4+、Mg2+、Al3+、Fe3+、Cl-、SO42-、CO32- 等离子,在此溶液中加入氢氧化钠溶液并加热,结果发现没有气体生成.但有白色沉淀产生.加入的氢氧化钠溶液体积(V)和产生的沉淀量m的关系如图所示.则溶液中一定存在的离子是Mg2+、Al3+,一定不存在的离子是NH4+、Fe3+、CO32-.