题目内容
4.在一个密闭容器中,有一个左右可滑动隔板,两边分别进行可逆反应,各物质的量如下:M、N、P为2.5mol、3.0mol、1.0mol.A、C、D各为0.50mol,B的物质的量为x,当x的
物质的量在一定范围内变化,均可以通过调节反应器的温度,使两侧反应均达到平衡,且隔板在反应器的正中位置.达到平衡后,测得M的转化率为75%,填写空白:
(1)若要使右室反应开始时V正>V逆,x的取值范围2.0<x<3.0.
(2)若要使右室反应开始时V正<V逆,x的取值范围1.5<x<2.0.
分析 (1)左室中的反应中,N为固体,反应恰好气体的体积不变,据此判断达到平衡时左室中气体的物质的量;要使右室反应开始时V正>V逆,平衡向着正向移动,正反应是体积缩小的反应,达到平衡时B的物质的量越大,则x值最小;当A接近完全反应时B的物质的量变化最大,且剩余的气体为B时,B的物质的量最大,据此计算出x的范围;
(2)反应A(g)+4B(g)?2C(g)+D(g)的逆反应为体积增大的反应,最初加入的物质为3.5mol,平衡基本不移动,各物质的物质的量除了A、C、D的物质的量各0.5mol以外,剩余全部为B,此时B的物质的量最大,增大值为:3.5mol-0.5mol×3=2mol;当0.5molC接近完全反应时,B的物质的量最小,据此计算出x的范围.
解答 解:(1)左室中的可逆反应中,反应前后气体的体积不变,则达到平衡时气体的总物质的量不变,反应前M为2.5mol、P为1mol,总物质的量为:2.5mol+1mol=3.5mol,则达到平衡时气体的物质的量也是3.5mol,
达到平衡时左右可滑动隔板处于中间,说明达到平衡时左室和右室气体的总物质的量相等,都是3.5mol,反应A(g)+4B(g)=2C(g)+D(g)是气体体积减小的反应,若欲使右室V正>V逆,需要压强增大,平衡正向进行,起始量A、C、D各为0.5mol,B为xmol,则0.5+0.5+0.5+x>3.5,解得x>2.0;
当达到平衡时气体全部为C、D时,B的物质的量最大,根据反应A(g)+4B(g)?2C(g)+D(g)可知,0.5molA完全反应消耗2molB,同时生成1molC、0.5molC,此时C的总物质的量为1mol+0.5mol=1.5mol,D的物质的量为0.5mol+0.5mol=1mol,总物质的量为:1.5mol+1mol=2.5mol,剩余的3.5-2.5mol=1mol为B时,B的物质的量最大,所以B的物质的量最大为:2mol+1mol=3mol,所以x是范围为:2.0<x<3.0,
故答案为:2.0<x<3.0;
(2)达到平衡时左右可滑动隔板处于中间,说明达到平衡时左室和右室气体的总物质的量相等,都为3.5mol,右室中的逆反应为体积增大的反应,当反应A(g)+4B(g)?2C(g)+D(g)中最初加入的四种物质的总物质的量为3.5mol,且平衡不移动,B的物质的量最大,若满足V正<V逆,则B的物质的量小于:3.5mol-0.5mol×3=2mol;
当达到平衡时气体全部为A、B时,B的物质的量最小,根据反应A(g)+4B(g)?2C(g)+D(g)可知,0.5molC完全反应生成1molB,此时B的物质的量为:1mol+0.5mol,由于V正<V逆,平衡向着逆向移动,则B的物质的量一定大于1.5mol,所以x是范围为:1.5<x<2.0,
故答案为:1.5<x<2.0.
点评 本题考查了化学平衡的计算,题目难度较大,明确左侧反应前后气体体积不变的特点为解答关键,注意掌握讨论法在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案①CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-23.5k1•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41.2kJ•mol-1
(1)催化反应室中总反应的热化学方程式为3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ•mol-1.
830℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0(填“>”、“<”或“=”).
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L、c(H2)=2.4mol/L,5min后达到平衡、CO的转化率为50%,则5min内CO的平均反应速率为0.1mol/(L•min).
(3)反应②2CH3OH(g)═CH3OCH3(g)+H2O(g) 在某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.64 | 0.50 | 0.50 |
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=0.04mol•L-1.
(4)“二甲醚燃料电池”是一种绿色电源,其中工作原理如图所示.
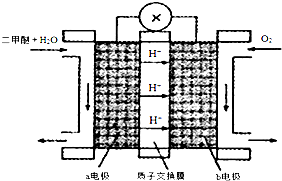
①该电池a电极上发生的电极反应式CH3OCH3+3H2O-12e-=2CO2+12H+.
②如果用该电池作为电解装置,当有23g二甲醚发生反应时,则理论上提供的电量表达式为0.5mol×12×1.6×10-19C×6.02×1023
mol-1C (1个电子的电量为1.6×10-19C).
 分子中在同一平面的碳原子数最多有( )
分子中在同一平面的碳原子数最多有( )| A. | 8 | B. | 9 | C. | 10 | D. | 11 |

| A. | T1<T2,Q>0 | |
| B. | 增大压强,B的转化率减小 | |
| C. | 当混合气体的密度不再变化,反应达平衡状态 | |
| D. | a+b<c+d |
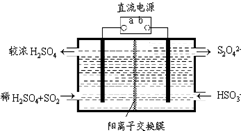 氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.
氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.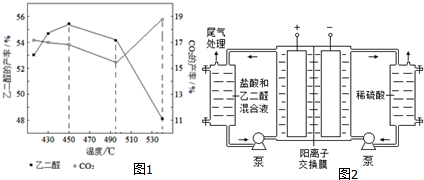

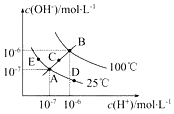 已知水的电离平衡曲线如图示,试回答下列问题:
已知水的电离平衡曲线如图示,试回答下列问题: