题目内容
10.t℃时,将3mol A和2mol B气体通入体积为2L的固定密闭容器中,发生反应:2A(g)+B(g)?x C(g),2min时反应达到平衡状态(温度不变),剩余1.5mol B,并测得C的浓度为0.5mol/L.试求:(1)x=2;
(2)A的转化率为多少?
(3)t℃时该反应的平衡常数.(注:写出必要的计算过程)
分析 根据三段式解题法,求出反应混合物各组分的物质的量的变化量、平衡时组分的物质的量
(1)根据化学计量数之比等于物质的量之比计算x的值;
(2)由转化率=$\frac{物质的转化量}{物质的起始量}×100%$计算;
(3)根据化学平衡常数K为生成物浓度幂之积与反应物浓度幂之积之比计算.
解答 解:据三段式解题法,求出反应混合物各组分的物质的量的变化量、平衡时组分的物质的量.
平衡时,c的物质的量为2L×0.5mol/L=1mol,
2A (g)+B (g)?x C(g),
开始(mol):3 2 0
变化(mol):1 2-1.5=0.5 1
平衡(mol):2 1.5 1
(1)化学计量数之比等于物质的量之比,所以1:x=1mol:1mol,解得x=2,
故答案为:2;
(2)A的转化率=$\frac{1}{3}×100%$=33.3%;
故答案为:33.3%;
(3)t℃时该反应的平衡常数K=$\frac{{c}^{2}(C)}{{c}^{2}(A)•c(B)}$=$\frac{(1mol÷2L)^{2}}{(2mol÷2L)^{2}(1.5÷2L)}$=$\frac{1}{3}$.
故答案为:$\frac{1}{3}$.
点评 本题考查化学平衡计算,难度不大,比较基础,侧重对基础知识的巩固,注意对速率公式的理解与灵活运用以及基础知识掌握与三段式解题法运用.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
5.N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)?4NO2(g)+O2(g);△H>0,T1温度时,向密闭容器中通入N2O5,部分实验数据见表下列说法中不正确的是( )
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内用O2表示的平均速率为1.48×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| C. | T1温度下N2O5的平衡转化率为50% | |
| D. | 平衡后其它条件不变,将容器的体积压缩到原来的一半,则再平衡时c(N2O5)>5.00mol/L |
15.下列溶液中Na+与50mL 3mol•L-1 NaCl溶液中Na+物质的量浓度相等的是( )
| A. | 150 mL 1 mol•L-1Na3PO4溶液 | B. | 75 mL 2 mol•L-1NaNO3溶液 | ||
| C. | 75 mL 3 mol•L-1Na2SO4溶液 | D. | 150 mL 2mol•L-1NaCl溶液 |
2.乙醇分子结构中化学键如图所示,关于乙醇在各种反应中断键的说明不正确的是( )
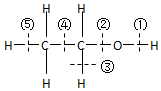

| A. | 和金属钠反应是键①断裂 | B. | 和浓硫酸共热到170℃时断键②和⑤ | ||
| C. | 和浓硫酸共热到140℃时仅断键② | D. | 和浓氢溴酸混合加热时断键② |
20.对某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸能产生无色气体,则一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有Ag+ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则一定有NH4+ | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ca2+ |
