题目内容
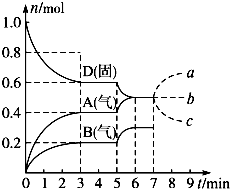 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,据图回答下列问题:
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,据图回答下列问题:(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为
(2)根据上图写出该反应的化学方程式
(3)第5min时,升高温度,A、B、D的物质的量变化如上图,则该反应的正反应是
(4)若在第7min时增加D的物质的量,A的物质的量变化正确的是
(5)一定温度下,在1L密闭容器中充入1mol N2和3mol H2并发生反应.若容器容积恒定,10min达到平衡时,气体的总压强为原来的
| 9 |
| 10 |
考点:化学平衡常数的含义,化学平衡的计算
专题:化学平衡专题
分析:(1)根据V=
进行计算;
(2)根据各物质的增减判断反应物、生成物,根据同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比判断;化学平衡常数等于平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
(3)根据温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动;根据平衡常数只有与温度有关;温度升高化学反应速率加快;
(4)增加固体的物质的量,浓度不变,平衡不移动;
(5)依据化学平衡三段式列式计算,气体压强之比等于气体物质的量之比,转化率=
×100%.
| △c |
| △t |
(2)根据各物质的增减判断反应物、生成物,根据同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比判断;化学平衡常数等于平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
(3)根据温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动;根据平衡常数只有与温度有关;温度升高化学反应速率加快;
(4)增加固体的物质的量,浓度不变,平衡不移动;
(5)依据化学平衡三段式列式计算,气体压强之比等于气体物质的量之比,转化率=
| 消耗量 |
| 起始量 |
解答:
解:(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为
=0.067mol/L?min,
故答案为:0.067;
(2)根据图象知,随着反应的进行,D的物质的量减少,A、B的物质的量增加,所以D是反应物,A、B是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,0-3min时,△D=0.4mol,
△A=0.4mol,△B=0.2mol,△D:△A:△B=0.4mol:0.4mol:0.2mol=4:4:2,方程式为:2D(s)?2A(g)+B(g);
故答案为:2D(s)?2A(g)+B(g)
因D为固体,所以化学平衡常数K=C2(A)×C(B),
故答案为:K=C2(A)×C(B);
(3)温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动,说明正反应为吸热反应,
平衡常数只有与温度有关,温度升高,平衡正向移动,平衡常数增大;
温度升高化学反应B的反应速率加快;
故答案为:吸热;增大;增大;
(4)D为固体,增加D的物质的量,浓度不变,平衡不移动,故选:b;
(5)一定温度下,在1L密闭容器中充入1mol N2和3mol H2并发生反应.若容器容积恒定,10min达到平衡时,气体的总压强为原来的
,依据化学平衡三段式列式计算,设氮气消耗物质的量为x;
N2+3H2=2NH3
起始量(mol) 1 3 0
变化量(mol) x 3x 2x
平衡量(mol) 1-x 3-3x 2x
气体的总压强为原来的
,则1-x+3-3x+2x=
×(1+3)
x=0.2mol
则N2的转化率α(N2)=
×100%=20%;
故答案为:20%.
| ||
| 3min |
故答案为:0.067;
(2)根据图象知,随着反应的进行,D的物质的量减少,A、B的物质的量增加,所以D是反应物,A、B是生成物;同一反应、同一时间段内,各物质的浓度变化量之比等于其计量数之比,0-3min时,△D=0.4mol,
△A=0.4mol,△B=0.2mol,△D:△A:△B=0.4mol:0.4mol:0.2mol=4:4:2,方程式为:2D(s)?2A(g)+B(g);
故答案为:2D(s)?2A(g)+B(g)
因D为固体,所以化学平衡常数K=C2(A)×C(B),
故答案为:K=C2(A)×C(B);
(3)温度升高,D的物质的量减少,A、B的物质的量增大,平衡正向移动,而温度升高,平衡向吸热的方向移动,说明正反应为吸热反应,
平衡常数只有与温度有关,温度升高,平衡正向移动,平衡常数增大;
温度升高化学反应B的反应速率加快;
故答案为:吸热;增大;增大;
(4)D为固体,增加D的物质的量,浓度不变,平衡不移动,故选:b;
(5)一定温度下,在1L密闭容器中充入1mol N2和3mol H2并发生反应.若容器容积恒定,10min达到平衡时,气体的总压强为原来的
| 9 |
| 10 |
N2+3H2=2NH3
起始量(mol) 1 3 0
变化量(mol) x 3x 2x
平衡量(mol) 1-x 3-3x 2x
气体的总压强为原来的
| 9 |
| 10 |
| 9 |
| 10 |
x=0.2mol
则N2的转化率α(N2)=
| 0.2mol |
| 1mol |
故答案为:20%.
点评:本题考查了化学平衡、平衡常数的影响因素,平衡计算分析应用,掌握基础是关键,题目较简单.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、常温常压下,11.2 L氧气所含的原子数为NA |
| B、1.8g的NH4+离子中含有的电子数为10NA |
| C、常温常压下,48g O3含有的氧原子数为3NA |
| D、0.1mol/L的FeCl3溶液所含Cl-数目为0.3NA |
在恒温下容积固定的密闭容器中,能充分说明反应 2NO+O2?2NO2 已达到平衡状态的是( )
| A、反应容器中的气体压强不随时间而变化 |
| B、生成O2的速率与生成NO2的速率相等 |
| C、NO、O2、NO2各浓度之比为2:1:2 |
| D、混合气体的密度一定 |
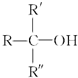 不能被氧化剂氧化(R,R′,R″均表示烃基),根据上述反应机理回答下列问题:
不能被氧化剂氧化(R,R′,R″均表示烃基),根据上述反应机理回答下列问题: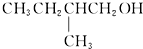 在有Cu和加热条件下与O2反应的化学方程式
在有Cu和加热条件下与O2反应的化学方程式 实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.
实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫,有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.